摘要:12.某元素X的原子核外电子数等于核内中子数.取2.8 g 该元素的单质与氧气充分作用.可得到6 g化合物XO2.该元素在周期表中的位置是 A.第三周期 B.第二周期 C.第Ⅳ主族 D.第Ⅴ主族
网址:http://m.1010jiajiao.com/timu3_id_148407[举报]
某元素X的原子核外电子数等于核内中子数,取该元素的单质2.8g与氧气充分反应可得6g化合物 ,该元素在周期表中的位置
,该元素在周期表中的位置
[ ]
|
A.第二周期 |
B.第三周期 |
C.第ⅣA族 |
D.第ⅤA族 |
某元素X的原子核外电子数等于核内中子数,取该元素的单质2.8g与氧气充分反应可得6g化合物 ,该元素在周期表中的位置
,该元素在周期表中的位置
[ ]
|
A.第二周期 |
B.第三周期 |
C.第ⅣA族 |
D.第ⅤA族 |
某元素X的原子核外电子数等于核内中子数,取2.8g此元素的单质与氧充分反应,可得6g 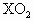 .有关元素X的说法正确的是
.有关元素X的说法正确的是
[ ]
A.X位于周期表中第二周期ⅤA族
B.X位于周期表中第三周期ⅣA族
C.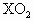 晶体熔点高,硬度大
晶体熔点高,硬度大
D.X的气态氢化物的水溶液呈强酸性
查看习题详情和答案>>|
某元素X的原子核外电子数等于核内中子数,取该元素的单质2.8 g跟氧气充分作用,可得到6.0 g化合物XO2,该元素在周期表中的位置是 | |
A. |
第二周期,ⅣA族 |
B. |
第三周期,ⅣA族 |
C. |
第二周期,ⅥA族 |
D. |
第三周期,ⅥA族 |
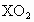 ,该元素在周期表中的位置是
,该元素在周期表中的位置是