题目内容
|
某元素X的原子核外电子数等于核内中子数,取该元素的单质2.8 g跟氧气充分作用,可得到6.0 g化合物XO2,该元素在周期表中的位置是 | |
A. |
第二周期,ⅣA族 |
B. |
第三周期,ⅣA族 |
C. |
第二周期,ⅥA族 |
D. |
第三周期,ⅥA族 |
答案:B
解析:
解析:
|
根据题给氧化物XO2可知,该元素为+4价,设该元素的原子量为x,则有 |

练习册系列答案
相关题目
某元素X的原子核外电子数等于核内中子数,取该元素的单质2.8g与氧气充分反应可得6g化合物 ,该元素在周期表中的位置
,该元素在周期表中的位置
[ ]
|
A.第二周期 |
B.第三周期 |
C.第ⅣA族 |
D.第ⅤA族 |
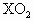 .有关元素X的说法正确的是
.有关元素X的说法正确的是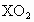 ,该元素在周期表中的位置是
,该元素在周期表中的位置是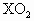 .有关元素X的说法正确的是
.有关元素X的说法正确的是