摘要:将Na2S.Na2SO3.Na2SO4按一定比例混合配成溶液.做如下实验: (1)混合溶液与过量的某无氧酸甲反应.得浅黄色沉淀A和无色溶液B, (2)无色溶液B与某硝酸盐溶液乙反应.得白色沉淀C和溶液D, (3)在溶液D中加入某硝酸盐溶液丙.得黄色沉淀E.再加入少量稀硝酸.E不溶解. 写出下列物质的化学式:甲: 乙: A: C: E: 写出以上三步实验中反应的离子方程式: (1) (2) (3)
网址:http://m.1010jiajiao.com/timu3_id_148108[举报]
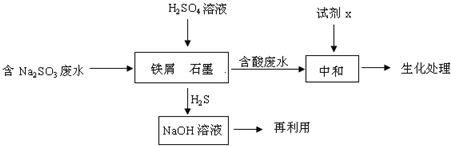
(2011?丰台区一模)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用.
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
②写出H2S气体与足量NaOH溶液反应的化学方程式
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
查看习题详情和答案>>
(1)某制革厂含硫废水中主要含有物是Na2S.
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
S2-+H2O HS-+OH-
HS-+OH-
 HS-+OH-
HS-+OH-S2-+H2O HS-+OH-
HS-+OH-
. HS-+OH-
HS-+OH-②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
1:2
1:2
.已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H>
>
0(填“>”“=”或“<”).(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:
①中和含酸废水工业常用的试剂x是
石灰水
石灰水
.②写出H2S气体与足量NaOH溶液反应的化学方程式
H2S+2NaOH=Na2S+2H2O
H2S+2NaOH=Na2S+2H2O
.③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
SO32-+8H++6e-=H2S↑+3H2O
SO32-+8H++6e-=H2S↑+3H2O
.④已知:2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=-632.8kJ/mol
SO2(g)=S(s)+O2(g)△H=+269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-1172.4kJ/mol
.
(2011?茂名二模)化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定性定量分析,确定固体组成与Na2SO3无异;但把加热后固体溶于水,得到的溶液pH值比Na2SO3溶液的pH高.
(1)Na2SO3溶液呈
(2)强热后的物质是什么呢?同学作如下探究
①分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
②该残留物可能的存在物质:
假设1:
假设2:
③设计实验方案证明你的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol?L-1 HCl、0.1mol?L-1BaCl2、0.1mol?L-1KCl、蒸馏水)
查看习题详情和答案>>
(1)Na2SO3溶液呈
碱
碱
性(填“酸”或“碱”),其原理是(以相关的离子方程式表示)SO32-+H2O HSO3-+OH-
HSO3-+OH-
 HSO3-+OH-
HSO3-+OH-SO32-+H2O HSO3-+OH-
HSO3-+OH-
. HSO3-+OH-
HSO3-+OH-(2)强热后的物质是什么呢?同学作如下探究
①分析猜想:Na2SO3在强热下发生了分解反应(自身氧化还原反应)
②该残留物可能的存在物质:
假设1:
Na2S和Na2SO4
Na2S和Na2SO4
;假设2:
Na2S、Na2SO3和Na2SO4
Na2S、Na2SO3和Na2SO4
.③设计实验方案证明你的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol?L-1 HCl、0.1mol?L-1BaCl2、0.1mol?L-1KCl、蒸馏水)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解 |
| 步骤2: | |
| 步骤3 |
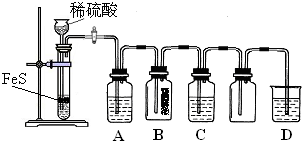
(2013?海淀区二模)硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒;存在于多种生产过程以及自然界中.在人体的很多生理过程中也起着重要作用.
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示.A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液.
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
②B中的现象是
③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
④D中盛放的试剂可以是
a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
已知:电离平衡常数:H2S Ka1=1.3×10-7;Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
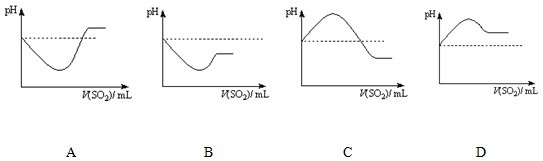
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
查看习题详情和答案>>
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为
H2S+CuSO4=CuS↓+H2SO4
H2S+CuSO4=CuS↓+H2SO4
.②B中的现象是
蓝色石蕊试纸变红
蓝色石蕊试纸变红
.③C中只有浅黄色沉淀产生,且溶液变浅绿色.则C中发生反应的离子方程式为
H2S+2Fe3+=S↓+2H++2Fe2+
H2S+2Fe3+=S↓+2H++2Fe2+
.④D中盛放的试剂可以是
d
d
(填标号).a.水 b.盐酸 c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 Ka1=1.7×10-2;Ka2=5.6×10-8
①根据上述实验,可以得出结论:在
酸性(或酸性较强)
酸性(或酸性较强)
条件下,+4价硫的化合物可以氧化-2价硫的化合物.②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是
C
C
(填序号).
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应
.
硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题.
(1)将H2S气体通入FeCl3溶液中,现象是 ;反应的离子方程式是 .
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
已知:电离平衡常数:H2S K1=1.3×10-7;K2=7.1×10-15
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在 条件下,+4价硫的化合物可以氧化-2价硫的化合物.
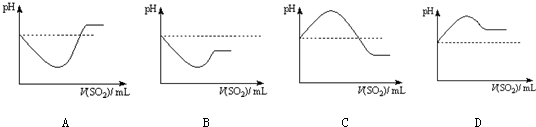
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是 (选填编号).
(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有 ,看到的现象是 .要证明Na2SO3具有氧化性,应选用的试剂有 ,反应的离子方程式是 .
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应 .
查看习题详情和答案>>
(1)将H2S气体通入FeCl3溶液中,现象是
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
H2SO3 K1=1.7×10-2;K2=5.6×10-8
①根据上述实验,可以得出结论:在
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是

(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水.要证明Na2SO3具有还原性,应选用的试剂有
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2.现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应
无机化合物可以根据其组成和性质进行分类:

(1)上图所示的物质分类方法名称是
(2)以Na、K、H、O、C、S、N等元素中任选两种或三种元素组成合适的一种物质,将其化学式分别填在下表中的相应位置.
(3)写出⑤、⑦两种物质相互转化的化学方程式:
⑤→⑦:
查看习题详情和答案>>

(1)上图所示的物质分类方法名称是
树状分类法
树状分类法
.(2)以Na、K、H、O、C、S、N等元素中任选两种或三种元素组成合适的一种物质,将其化学式分别填在下表中的相应位置.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② H2CO3或H2SO4、H2SO3、H2S、HNO3、HNO2 H2CO3或H2SO4、H2SO3、H2S、HNO3、HNO2 |
③ KOH或NaOH KOH或NaOH ④Ba(OH)2 |
⑤Na2CO3 ⑥ K2CO3或K2S、K2SO3、K2SO4、KNO3、KNO2、Na2S、Na2SO3、Na2SO4、NaNO3、NaNO2 K2CO3或K2S、K2SO3、K2SO4、KNO3、KNO2、Na2S、Na2SO3、Na2SO4、NaNO3、NaNO2 |
⑦CO2 ⑧Na2O |
⑨NH3 ⑩H2O2 |
⑤→⑦:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
;⑦→⑤:CO2+2NaOH=Na2CO3+H2O
CO2+2NaOH=Na2CO3+H2O
.