摘要: 加热84g NaHCO3到没有气体放出时.剩余的物质是什么?计算剩余物质的质量.
网址:http://m.1010jiajiao.com/timu3_id_146689[举报]
实验室需要0.1mol?L-1NaOH溶液450mL和0.5mol?L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是
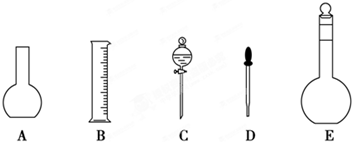
(2)容量瓶不能用于
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
(4)根据计算得知,所需质量分数为98%、密度为1.84g?cm-3的浓硫酸的体积为
查看习题详情和答案>>
(1)如图所示的仪器中配制溶液肯定不需要的是
AC
AC
(填序号),配制上述溶液还需用到的玻璃仪器是烧杯和玻璃棒
烧杯和玻璃棒
(填仪器名称).
(2)容量瓶不能用于
BCF
BCF
(填序号).A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为
2.0
2.0
g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度小于
小于
0.1mol?L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度小于
小于
0.1mol?L-1.(4)根据计算得知,所需质量分数为98%、密度为1.84g?cm-3的浓硫酸的体积为
13.6
13.6
mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用15
15
mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌
将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌
. 实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:C2H5-OH+HBr
| 浓H2SO4 |
| △ |
已知反应物的用量为:0.30mol NaBr(s);0.25mol C2H5OH(密度为0.80g?cm-3);36mL浓H2SO4(质量分数为98%,密度为1.84g?mL-1);25mL水.试回答下列问题.
(1)该实验应选择图中的a装置还是b装置?
a
a
.(2)反应装置中的烧瓶应选择下列哪种规格最合适
C
C
A.50mL B.100mL C.150mL D.250mL
(3)冷凝管中的冷凝水的流向应是
B
B
A.A进B出 B.B进A出 C.从A进或B进均可
(4)可能发生的副反应为:
2C2H5OH
C2H5OC2H5+H2O
| 浓硫酸 |
| 140℃ |
2C2H5OH
C2H5OC2H5+H2O
、| 浓硫酸 |
| 140℃ |
2HBr+H2SO4(浓)
Br2+SO2↑+2H2O
| ||
2HBr+H2SO4(浓)
Br2+SO2↑+2H2O
、
| ||
C2H5OH+2H2SO4(浓)
2C+2SO2↑+5H2O
| △ |
C2H5OH+2H2SO4(浓)
2C+2SO2↑+5H2O
(至少写出3个方程式).| △ |
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是
将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
将粗溴乙烷和稀NaOH(aq)的混合物放在分液漏斗中用力振荡,并不断放气,至油层无色,分液可得纯溴乙烷
.某化学兴趣小组测定某Fe2(SO4)3样品(只含少量Fec12杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
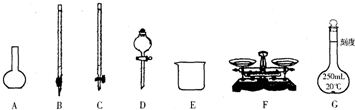
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和 (填字母).
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为 mL,量取该体积的浓H2SO4用到量筒规格是 .
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
Fe2++ ClO2+ ═ Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的ClO2与Cl2的氧化效率之比为 .
(4)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 .
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会 (填偏大、偏小或不影响);若容器质量是W1g,最终容器和固体的总质量是W2g,则样品中铁元素的质量分数为 ,(列出算式,不需化简)
查看习题详情和答案>>
①称取ag样品,置于烧杯中;
②加入50mL 1.0mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤 ②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…

请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和
(2)步骤②中:配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成
(4)第⑥步的操作中,将沉淀物转移到
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会
(2011?闵行区二模)天然水由于长期与土壤、岩石等接触,会溶有一定量的Ca2+、Mg2+、HCO3-等,这样的水在加热过程中很容易形成水垢.水垢可以看作由多种物质如:CaCO3、MgCO3、Mg(OH)2等中的若干种物质组成的混合物,某学习小组为研究含有Ca2+、Mg2+、HCO3-的自来水所形成水垢的化学组成,取干燥的水垢6.32g,加热使其失去结晶水后,得到5.78g剩余固体A;高温灼烧A至恒重,残余固体为CaO和MgO,放出的气体用足量Ba(OH)2溶液吸收,得到11.82g沉淀.
(1)通过计算确定A中的碳酸盐是
a.只有CaCO3 b.只有MgCO3 c.既有CaCO3又有MgCO3
写出计算过程:
(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量.若用a CaCO3?b MgCO3?x Mg(OH)2?y H2O表示原水垢(若a、b、x、y中有为0的,则该项略去,a、b、x、y用最简整数比),通过计算确定原水垢的化学式.
(3)该学习小组用该水垢模拟石灰窑反应,取该水垢与碳粉混合,通入一定量空气(假定不考虑其它气体,N2与O2体积比为:4:1),在密闭容器中,用喷灯加热至1000℃左右充分反应后,冷却到室温,测得最后所得气体中各种成分的体积含量如下:
O2:0.3%;CO:0.4%;CO2:42.5%;其余为N2.[已知:Mg(OH)2分解温度为270℃左右,MgCO3分解温度为400℃左右,CaCO3分解温度900℃左右].
求该小组所取水垢和碳粉的质量比(结果保留2位小数).
查看习题详情和答案>>
(1)通过计算确定A中的碳酸盐是
c
c
(填答案编号).a.只有CaCO3 b.只有MgCO3 c.既有CaCO3又有MgCO3
写出计算过程:
n(CO2)=n(BaCO3)=
=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g>5.78g,假设二氧化碳全部来自碳酸镁,则m(MgCO3)=0.06mol×84g/mol=5.04g<5.78g,故A既含有CaCO3,又含有MgCO3
| 11.82g |
| 197g/mol |
n(CO2)=n(BaCO3)=
=0.06mol,假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g>5.78g,假设二氧化碳全部来自碳酸镁,则m(MgCO3)=0.06mol×84g/mol=5.04g<5.78g,故A既含有CaCO3,又含有MgCO3
| 11.82g |
| 197g/mol |
(2)5.78g剩余固体A灼烧至恒重时产生的气体完全被碱石灰吸收,碱石灰增重2.82g,通过计算确定A中各成分的物质的量.若用a CaCO3?b MgCO3?x Mg(OH)2?y H2O表示原水垢(若a、b、x、y中有为0的,则该项略去,a、b、x、y用最简整数比),通过计算确定原水垢的化学式.
(3)该学习小组用该水垢模拟石灰窑反应,取该水垢与碳粉混合,通入一定量空气(假定不考虑其它气体,N2与O2体积比为:4:1),在密闭容器中,用喷灯加热至1000℃左右充分反应后,冷却到室温,测得最后所得气体中各种成分的体积含量如下:
O2:0.3%;CO:0.4%;CO2:42.5%;其余为N2.[已知:Mg(OH)2分解温度为270℃左右,MgCO3分解温度为400℃左右,CaCO3分解温度900℃左右].
求该小组所取水垢和碳粉的质量比(结果保留2位小数).
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是
AC
AC
(填序号),仪器C的名称是分液漏斗
分液漏斗
,本实验所需玻璃仪器E规格为500
500
mL.(2)下列操作中,容量瓶所不具备的功能有
BCD
BCD
(填序号).A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度
小于
小于
0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度大于
大于
0.1mol/L.(4)根据计算得知,配制所需NaOH固体质量
2.0
2.0
g.配制所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为13.6
13.6
mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用25
25
mL规格的量筒最好.