摘要:今欲测定某样品四氧化三铅含量.称取Pb3O40.1000g.加酸溶解.得到含Pb2+的溶液.加热下用过量K2Cr2O7将Pb2+沉淀为PbCrO4.反应为 2Pb2++Cr2O72-+H2O=2PbCrO4↓+2H+, 冷却后过滤洗涤.将PbCrO4沉淀用HCl溶液溶解.加入过量KI.用0.1000mol·L-1Na2S2O3溶液滴定.终点时用去12.00mL. ⒈写出PbCrO4沉淀溶解和滴定过程的化学方程式, 解: ⒉计算试样中Pb3O4的质量分数,(Pb3O4的相对分子质量为685.6) 解: ⒊用标准溶液滴定时应用指示剂? ⒋加入过量KI后.反应需在暗处放置5-10分钟.为了防止生成的I2挥发.可选用何种仪器?
网址:http://m.1010jiajiao.com/timu3_id_146592[举报]
(11分)四氧化三铅俗名“铅丹”或“红丹”,化学式可以写为2PbO?PbO2,铅丹用于制造铅玻璃,由于它有氧化性,涂在钢材上有利于钢铁表面的钝化,其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
今欲测定某样品四氧化三铅含量,称取Pb3O4 0.1000g,加酸溶解,得到含Pb2+的溶液,加热下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤,将PbCrO4沉淀用HCl溶液溶解,加入过量KI,用0.1000mol/L Na2S2O3溶液滴定,终点时用去12.00mL。
1.写出PbCrO4沉淀、溶解和滴定过程的化学方程式;
2.计算试样中Pb3O4的质量分数;
3.用标准溶液滴定时应用指示剂?
4.加入过量KI后,反应需在暗处放置5~10分钟。
(1)所加KI为什么要过量?
(2)为了防止生成的I2挥发,可选用何种仪器?
查看习题详情和答案>>
四氧化三铅(Pb3O4)俗名“红丹”,红丹中的PbO2在酸性条件下可以使Mn2+氧化为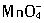 ,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
今欲测定某样品中四氧化三铅的含量,称取该样品0.1000g,加入过量盐酸溶解后产生Cl2。将Cl2通入KI溶液中析出I2,用0.0l00mol?L-1Na2S2O3溶液滴定,反应如下:2Na2S2O3+I2=Na2S4O6+2NaI,达到终点时用去 Na2S2O3溶液25.00mL。
(1)请将红丹的化学式改写成如FeO?Fe2O3的形式:_____________________。
(2)写出Pb3O4 与盐酸反应的化学方程式:____________________________。
(3)用标准Na2S2O3溶液滴定I2时,可以选用的指示剂是_____________,达到终点时的现象是_______________________________________________________。
(4)计算试样中Pb3O4的质量分数。 查看习题详情和答案>>
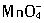 ,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。今欲测定某样品中四氧化三铅的含量,称取该样品0.1000g,加入过量盐酸溶解后产生Cl2。将Cl2通入KI溶液中析出I2,用0.0l00mol?L-1Na2S2O3溶液滴定,反应如下:2Na2S2O3+I2=Na2S4O6+2NaI,达到终点时用去 Na2S2O3溶液25.00mL。
(1)请将红丹的化学式改写成如FeO?Fe2O3的形式:_____________________。
(2)写出Pb3O4 与盐酸反应的化学方程式:____________________________。
(3)用标准Na2S2O3溶液滴定I2时,可以选用的指示剂是_____________,达到终点时的现象是_______________________________________________________。
(4)计算试样中Pb3O4的质量分数。 查看习题详情和答案>>