题目内容
(11分)四氧化三铅俗名“铅丹”或“红丹”,化学式可以写为2PbO?PbO2,铅丹用于制造铅玻璃,由于它有氧化性,涂在钢材上有利于钢铁表面的钝化,其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
今欲测定某样品四氧化三铅含量,称取Pb3O4 0.1000g,加酸溶解,得到含Pb2+的溶液,加热下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤,将PbCrO4沉淀用HCl溶液溶解,加入过量KI,用0.1000mol/L Na2S2O3溶液滴定,终点时用去12.00mL。
1.写出PbCrO4沉淀、溶解和滴定过程的化学方程式;
2.计算试样中Pb3O4的质量分数;
3.用标准溶液滴定时应用指示剂?
4.加入过量KI后,反应需在暗处放置5~10分钟。
(1)所加KI为什么要过量?
(2)为了防止生成的I2挥发,可选用何种仪器?
1.2Pb2++Cr2O72-+H2O=2PbCrO4↓+2H+
2PbCrO4+2H+=2Pb2++Cr2O72-+H2O
Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O
I2+2S2O32-=2I-+S4O62-(各1分)
2.Pb3O4~3Pb2+~3/2Cr2O72-~3×3/2I2~3×3/2×2S2O32-(1分)
Pb3O4%=91.41%(3分)
3.淀粉(1分)
4.(1)I-+I2![]() I3-,过量的KI可固定I2,防止挥发。(1分)
I3-,过量的KI可固定I2,防止挥发。(1分)
(2)碘量瓶(1分)

 名校课堂系列答案
名校课堂系列答案在21℃和充分搅拌下,将不同体积1.0 mol·L—1 HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
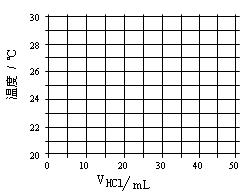 (1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(1)在给定的坐标图上绘出溶液温度与盐酸体积的关系图。
(2)假定酸碱恰好完全反应前后,溶液温度与盐酸体积可以近似
地认为呈线性关系。请写出溶液温度t与盐酸体积V的线性
关系式(请用含有t和V的式子表示) 、 。
(3)所用NaOH溶液的物质的量浓度= 。
备用 . 四氧化三铅俗名“铅丹”或“红丹”,由于有氧化性被大量地用于油漆船舶和桥梁钢架防锈,其化学式可写为2PbO·PbO2。欲测定某样品中四氧化三铅含量,进行如下操作:
①称取样品0.1000g,加酸溶解,得到含Pb2+的溶液。
②在加热条件下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤沉淀。
③将PbCrO4沉淀用酸溶液溶解(沉淀溶解的离子方程式为:2PbCrO4+2H+=
2Pb2+Cr2O72-+H2O),加入过量KI,再用0.1000mol·L―1 Na2S2O3溶液滴定,到滴定终点时用
去12.00mL(滴定过程中离子方程式为:I2+2S2O32-=2I-+S4O62-)。
则:(1)写出步骤③中加入过量KI后溶液中发生的离子反应方程式 。
(2)用标准溶液滴定时所用的指示剂是 。(写试剂名称)
(3)计算试样中Pb3O4的质量分数。(Pb的相对原子质量为207.2)
 下操作:
下操作: O62-)。
O62-)。 __族。
__族。 “减小”、“不变”)
“减小”、“不变”)