题目内容
四氧化三铅(Pb3O4)俗名“红丹”,红丹中的PbO2在酸性条件下可以使Mn2+氧化为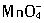 ,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。
,由于它具有氧化性,涂在钢材上有利于钢铁表面的钝化,故其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。今欲测定某样品中四氧化三铅的含量,称取该样品0.1000g,加入过量盐酸溶解后产生Cl2。将Cl2通入KI溶液中析出I2,用0.0l00mol?L-1Na2S2O3溶液滴定,反应如下:2Na2S2O3+I2=Na2S4O6+2NaI,达到终点时用去 Na2S2O3溶液25.00mL。
(1)请将红丹的化学式改写成如FeO?Fe2O3的形式:_____________________。
(2)写出Pb3O4 与盐酸反应的化学方程式:____________________________。
(3)用标准Na2S2O3溶液滴定I2时,可以选用的指示剂是_____________,达到终点时的现象是_______________________________________________________。
(4)计算试样中Pb3O4的质量分数。
(1)2PbO?PbO2
(2)Pb3O4+8HCl=3PbCl2+4H2O+Cl2↑
(3)淀粉溶液;溶液的蓝色刚好退去
(4)85.6%

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目