摘要:试卷结构:基本上采用了2004年高考中的独立化学卷结构.试卷包括选择题和非选择题两部分.选择题50分.非选择题50分.选择题均为单选题.
网址:http://m.1010jiajiao.com/timu3_id_146449[举报]
我国自行研制的“神舟七号’’飞船航天员航天服采用了很多新型超高性能复合材料.其中聚酰胺纤维M就是一种新型超高性能纤维,它的防热和防火性能十分出色.聚酰胺纤维M的结构简式为: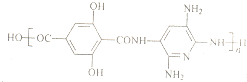
下面是聚酰胺纤维M的一种合成路线(部分反应未注明条件):
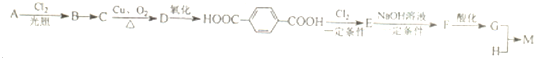
请回答:
(1)写出反应类型:A→B:
(2)生成B的同时可能生成B的一种同分异构体,其结构简式为
 ;
;
(3)写出反应的化学方程式:E→F: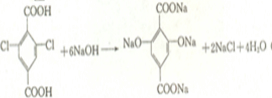
 ;
;
(4)聚酯纤维P是一种无毒的玩具内充物,结构简式如下:
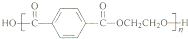
聚酯纤维P可用A 和乙烯为原料合成,请你设计并写出其合成路线.提示:
①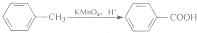
②合成过程中无机试剂任选.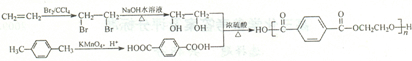
 .
.
查看习题详情和答案>>

下面是聚酰胺纤维M的一种合成路线(部分反应未注明条件):

请回答:
(1)写出反应类型:A→B:
取代反应
取代反应
,G+H→M:缩聚反应
缩聚反应
;(2)生成B的同时可能生成B的一种同分异构体,其结构简式为


(3)写出反应的化学方程式:E→F:


(4)聚酯纤维P是一种无毒的玩具内充物,结构简式如下:

聚酯纤维P可用A 和乙烯为原料合成,请你设计并写出其合成路线.提示:
①
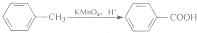
②合成过程中无机试剂任选.


I.有机物组成的测定
化学上常用燃烧法确定有机物的组成,这种方法是在电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成,图1所列装置是用燃烧法确定有机物A的分子式常用的装置.(每种装置只用一次)
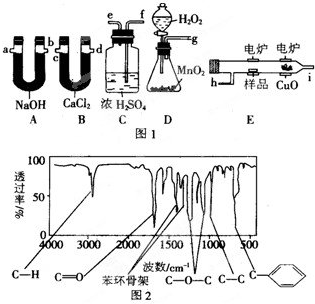
回答下列问题:
(1)产生的O2按从左到右流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若准确称取1.50g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加3.96g,B管质量增加0.90g,则该有机物A的实验式为
II.有机物结构的确定
为进一步确定上述有机物A的分子结构,采用了下列几种现代仪器进行分析,结果如下:
方法一:经质谱法分析得知A的相对分子质量为150.
方法二:核磁共振仪可以测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3.
方法三:利用红外光谱仪可测得A分子的红外光谱如图2所示.
已知:A分子中只含一个苯环,且苯环上只有一个取代基,且B的水解产物中含有乙醇.试回答下列问题:
(6)A的分子式为
(7)A的结构简式为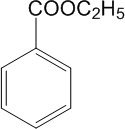
 .
.
查看习题详情和答案>>
化学上常用燃烧法确定有机物的组成,这种方法是在电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成,图1所列装置是用燃烧法确定有机物A的分子式常用的装置.(每种装置只用一次)

回答下列问题:
(1)产生的O2按从左到右流向,所选装置各导管的连接顺序是
g→f,e→h,i→c,d→a
g→f,e→h,i→c,d→a
(填接口代号).(2)C装置中浓H2SO4的作用是
吸收水分,得到干燥纯净的O2
吸收水分,得到干燥纯净的O2
.(3)D装置中MnO2的作用是
作催化剂,加快产生O2的速率
作催化剂,加快产生O2的速率
.(4)燃烧管中CuO的作用是
使有机物更充分氧化生成CO2和H2O
使有机物更充分氧化生成CO2和H2O
.(5)若准确称取1.50g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加3.96g,B管质量增加0.90g,则该有机物A的实验式为
C9H10O2
C9H10O2
.II.有机物结构的确定
为进一步确定上述有机物A的分子结构,采用了下列几种现代仪器进行分析,结果如下:
方法一:经质谱法分析得知A的相对分子质量为150.
方法二:核磁共振仪可以测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3.
方法三:利用红外光谱仪可测得A分子的红外光谱如图2所示.
已知:A分子中只含一个苯环,且苯环上只有一个取代基,且B的水解产物中含有乙醇.试回答下列问题:
(6)A的分子式为
C9H10O2
C9H10O2
.(7)A的结构简式为


(2012?洛阳二模)HN3称为叠氮酸,常温下为无色有刺激性气味的液体.用政与叠氮化钠反应可制得叠氮酸,而叠氮化钠可由NaNH2与N2O反应制得.叠氰黢和浓盐酸组成的混合液可溶解铜、铂、金等不活泼金属.试回答下列问题:
(1)基态氮原子核外电子排布式为.
(2)元素N、S、P的第一电离能(I1)由大到小的颗序为
(3)固体HN3属于
的空间构型为
(4)写出由NaNH2与N2O反应制叠氮化钠的化学方程式
(5)金与铜晶体结构相似,都采用了最密堆积,其堆积方式是
查看习题详情和答案>>
(1)基态氮原子核外电子排布式为.
1s22s22p3
1s22s22p3
(2)元素N、S、P的第一电离能(I1)由大到小的颗序为
N>P>S
N>P>S
.(3)固体HN3属于
分子
分子
晶体,与CNO-互为等电子体的分子的化学式为CO2
CO2
(写1种)NH- 2 |
V型
V型
,中心原子的杂化类型是SP3杂化
SP3杂化
.(4)写出由NaNH2与N2O反应制叠氮化钠的化学方程式
NaNH2+N2O=NaN3+H2O
NaNH2+N2O=NaN3+H2O
(5)金与铜晶体结构相似,都采用了最密堆积,其堆积方式是
ABCABC…
ABCABC…
(填“ABAB…”或“ABCABC…”),配位数为12
12
若金的密度为ρ?g/cm3,则金晶胞的边长为a=
×1010
| 3 |
| ||
a=
×1010
pm(只要求列算式,不必计算出数值,金的相对原子质量为M,阿伏伽德罗常数为NA.| 3 |
| ||
(2010?丰台区一模)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格内(不用配平).该反应过程中,被氧化与被还原的元素的物质的量之比为
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3.电池正极的电极反应式为
(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为

查看习题详情和答案>>
5:3
5:3
.(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3.电池正极的电极反应式为
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
;正极材料采用了铂网,利用铂网为正极的优点是铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积
.(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol
.(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为
2.016
2.016
L(标准状况).
 用右图所示实验装置制取乙酸乙酯.回答以下问题:
用右图所示实验装置制取乙酸乙酯.回答以下问题:(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的 方法是:先向试管中加入一定量的
乙醇
乙醇
,然后边振荡边缓缓加入浓硫酸
浓硫酸
,冷却后再加入一定量的冰醋酸
冰醋酸
,轻轻振荡使之混合均匀.(2)浓硫酸的作用是:
催化剂、吸水剂
催化剂、吸水剂
.(3)饱和碳酸钠溶液的作用是:①
降低乙酸乙酯的溶解度
降低乙酸乙酯的溶解度
;②吸收乙醇
吸收乙醇
;③中和乙酸
中和乙酸
;(4)生成的乙酸乙酯,其密度比水
小
小
(填“大”或“小”),有香
香
味.(5)若实验中反应温度不当,使反应温度维持在140℃左右,此时副反应的主要有机产物的结构简式为:
CH3CH2OCH2CH3
CH3CH2OCH2CH3
.(6)与书中采用的实验装置的不同之处是:本实验采用了球形干燥管代替了长导管,并将干燥管的末端插入了饱和碳酸钠溶液中.在此处球形干燥管的作用有:
①
防止倒吸
防止倒吸
,②使蒸汽与溶液充分接触
使蒸汽与溶液充分接触
.