摘要:1] Na2SO3+SO2+H2O=2NaHSO3.2NaHSO3=Na2SO3+SO2↑+H2O
网址:http://m.1010jiajiao.com/timu3_id_146371[举报]
24mL浓度为0.05mol?L-1 Na2SO3溶液恰好与20mL浓度为0.02mol?L-1的K2X2O7溶液完全反应,已知Na2SO3可被K2X2O7氧化为Na2SO4,则元素X在还原产物中的化合价为下列的( )
查看习题详情和答案>>
(2011?漳州一模)化学兴趣小组对品红溶液褪色实验进行探究.限选实验仪器与试剂为:试管、滴管、试管夹、1.0mol?L-1 Na2SO3溶液、1.0mol?L-1 NaClO溶液、品红溶液.
[探究一]
①甲同学提出假设
假设1:NaClO溶液能使品红溶液褪色
假设2:Na2SO3溶液能使品红溶液褪色
假设3:
②设计实验方案证明甲的假设
[探究二]
乙同学为探究Na2SO3溶液是否发生变质,设计如下实验测定所用1.0mol?L-1 Na2SO3溶液的实际浓度: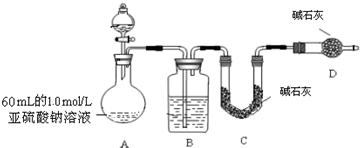
(1)分液漏斗中应加入足量的下列试剂
a.浓硝酸b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重 3.2g,则Na2SO3溶液实际的物质的量浓度为
(3)该实验装置还存在一个明显的缺陷是:
查看习题详情和答案>>
[探究一]
①甲同学提出假设
假设1:NaClO溶液能使品红溶液褪色
假设2:Na2SO3溶液能使品红溶液褪色
假设3:
NaClO溶液、Na2SO3溶液都不能使品红溶液褪色
NaClO溶液、Na2SO3溶液都不能使品红溶液褪色
.②设计实验方案证明甲的假设
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量品红溶液于试管中,再加入少量的 1.0mol?L-1NaClO溶液 1.0mol?L-1NaClO溶液 . |
若品红溶液褪色,则假设1成立. |
| 步骤2: 另取少量品红溶液于试管中, 另取少量品红溶液于试管中, 再加入少量的1.0mol?L-1Na2SO3溶液. 再加入少量的1.0mol?L-1Na2SO3溶液. 此处无空格 此处无空格 . |
若 品红溶液褪色 品红溶液褪色 ,则假设2成立. |
| 根据步骤1、2. | 若 步骤1、2的品红溶液均不褪色 步骤1、2的品红溶液均不褪色 ,则假设3成立. |
乙同学为探究Na2SO3溶液是否发生变质,设计如下实验测定所用1.0mol?L-1 Na2SO3溶液的实际浓度:

(1)分液漏斗中应加入足量的下列试剂
b
b
(填序号).a.浓硝酸b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重 3.2g,则Na2SO3溶液实际的物质的量浓度为
0.83mol?L-1
0.83mol?L-1
.(3)该实验装置还存在一个明显的缺陷是:
缺少一个驱赶残留二氧化硫气体的装置
缺少一个驱赶残留二氧化硫气体的装置
.下列说法正确的是( )
| A、加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、HCO3-、NO3- | B、在0.1 mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3-) | C、在0.1mol?L-1 Na2SO3溶液中:c(Na+)+c(H+)=2 c(SO32-)+2c(HSO3-)+c(OH-) | D、25℃时NH4Cl溶液的KW大于NaCl溶液的KW |