题目内容
(2011?漳州一模)化学兴趣小组对品红溶液褪色实验进行探究.限选实验仪器与试剂为:试管、滴管、试管夹、1.0mol?L-1 Na2SO3溶液、1.0mol?L-1 NaClO溶液、品红溶液.
[探究一]
①甲同学提出假设
假设1:NaClO溶液能使品红溶液褪色
假设2:Na2SO3溶液能使品红溶液褪色
假设3:
②设计实验方案证明甲的假设
[探究二]
乙同学为探究Na2SO3溶液是否发生变质,设计如下实验测定所用1.0mol?L-1 Na2SO3溶液的实际浓度: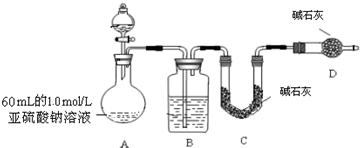
(1)分液漏斗中应加入足量的下列试剂
a.浓硝酸b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重 3.2g,则Na2SO3溶液实际的物质的量浓度为
(3)该实验装置还存在一个明显的缺陷是:
[探究一]
①甲同学提出假设
假设1:NaClO溶液能使品红溶液褪色
假设2:Na2SO3溶液能使品红溶液褪色
假设3:
NaClO溶液、Na2SO3溶液都不能使品红溶液褪色
NaClO溶液、Na2SO3溶液都不能使品红溶液褪色
.②设计实验方案证明甲的假设
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量品红溶液于试管中,再加入少量的 1.0mol?L-1NaClO溶液 1.0mol?L-1NaClO溶液 . |
若品红溶液褪色,则假设1成立. |
| 步骤2: 另取少量品红溶液于试管中, 另取少量品红溶液于试管中, 再加入少量的1.0mol?L-1Na2SO3溶液. 再加入少量的1.0mol?L-1Na2SO3溶液. 此处无空格 此处无空格 . |
若 品红溶液褪色 品红溶液褪色 ,则假设2成立. |
| 根据步骤1、2. | 若 步骤1、2的品红溶液均不褪色 步骤1、2的品红溶液均不褪色 ,则假设3成立. |
乙同学为探究Na2SO3溶液是否发生变质,设计如下实验测定所用1.0mol?L-1 Na2SO3溶液的实际浓度:

(1)分液漏斗中应加入足量的下列试剂
b
b
(填序号).a.浓硝酸b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重 3.2g,则Na2SO3溶液实际的物质的量浓度为
0.83mol?L-1
0.83mol?L-1
.(3)该实验装置还存在一个明显的缺陷是:
缺少一个驱赶残留二氧化硫气体的装置
缺少一个驱赶残留二氧化硫气体的装置
.分析:[探究一]
①根据假设1、2确定假设3,假设1、2褪色,则假设3不褪色;
②步骤1、要验证次氯酸钠有漂白性,应加入次氯酸钠溶液;
步骤2、要验证亚硫酸钠有漂白性,应加入亚硫酸钠和品红溶液,观察实验现象;
根据步骤1、2确定假设3是否成立;
[探究二]
(1)根据浓盐酸、浓硝酸和浓硫酸的性质判断应选取的物质;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,根据二氧化硫的质量计算亚硫酸钠固体中含有的亚硫酸钠,从而计算出其浓度;
(3)二氧化硫能储存在某些装置中.
①根据假设1、2确定假设3,假设1、2褪色,则假设3不褪色;
②步骤1、要验证次氯酸钠有漂白性,应加入次氯酸钠溶液;
步骤2、要验证亚硫酸钠有漂白性,应加入亚硫酸钠和品红溶液,观察实验现象;
根据步骤1、2确定假设3是否成立;
[探究二]
(1)根据浓盐酸、浓硝酸和浓硫酸的性质判断应选取的物质;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,根据二氧化硫的质量计算亚硫酸钠固体中含有的亚硫酸钠,从而计算出其浓度;
(3)二氧化硫能储存在某些装置中.
解答:解:[探究一]
①根据假设1、2确定假设3,假设1、2褪色,则假设3采取相反的假设,故假设3为NaClO溶液、Na2SO3溶液都不能使品红溶液褪色,
故答案为:NaClO溶液、Na2SO3溶液都不能使品红溶液褪色;
②要验证次氯酸钠使品红溶液褪色,应向盛有品红的溶液中加入次氯酸钠溶液,
要验证亚硫酸钠溶液使品红溶液褪色,应另取品红溶液于试管中,然后加入少量的亚硫酸钠溶液,观察溶液是否褪色来判断亚硫酸钠是否有漂白性,
如果假设1、2的品红溶液都不褪色,则假设3成立,
故答案为:
[探究二]
(1)a、浓硝酸有挥发性,且浓硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子而得不到二氧化硫气体,故错误;
b、稀硫酸的氧化性是氢元素表现,反应速率较慢,浓硫酸主要以分子存在,而亚硫酸钠和硫酸的反应是在溶液中以离子进行反应,所以用65%硫酸和亚硫酸钠固体反应制取二氧化硫,故正确;
c、浓盐酸有挥发性,会对实验造成干扰,故错误;故答案为:b;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,
设亚硫酸钠的物质的量浓度为C,
H2SO4+Na2SO3=H2O+Na2SO4+SO2↑
1mol 64g
0.06Cmol 3.2g
C=0.83mol?L-1,
故答案为:0.83mol?L-1;
(3)二氧化硫能储存在某些装置中导致碱石灰吸收的二氧化硫减少,造成偏差,所以存在的缺陷是:缺少一个驱赶残留二氧化硫气体的装置,
故答案为:缺少一个驱赶残留二氧化硫气体的装置.
①根据假设1、2确定假设3,假设1、2褪色,则假设3采取相反的假设,故假设3为NaClO溶液、Na2SO3溶液都不能使品红溶液褪色,
故答案为:NaClO溶液、Na2SO3溶液都不能使品红溶液褪色;
②要验证次氯酸钠使品红溶液褪色,应向盛有品红的溶液中加入次氯酸钠溶液,
要验证亚硫酸钠溶液使品红溶液褪色,应另取品红溶液于试管中,然后加入少量的亚硫酸钠溶液,观察溶液是否褪色来判断亚硫酸钠是否有漂白性,
如果假设1、2的品红溶液都不褪色,则假设3成立,
故答案为:
| 实验操作 | 预期现象与结论 |
| 1.0 mol?L-1 NaClO溶液 | |
| 另取少量品红溶液于试管中,再加入少量的1.0 mol?L-1 Na2SO3溶液. | 品红溶液褪色 |
| 步骤1、2的品红溶液均不褪色 |
(1)a、浓硝酸有挥发性,且浓硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子而得不到二氧化硫气体,故错误;
b、稀硫酸的氧化性是氢元素表现,反应速率较慢,浓硫酸主要以分子存在,而亚硫酸钠和硫酸的反应是在溶液中以离子进行反应,所以用65%硫酸和亚硫酸钠固体反应制取二氧化硫,故正确;
c、浓盐酸有挥发性,会对实验造成干扰,故错误;故答案为:b;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,
设亚硫酸钠的物质的量浓度为C,
H2SO4+Na2SO3=H2O+Na2SO4+SO2↑
1mol 64g
0.06Cmol 3.2g
C=0.83mol?L-1,
故答案为:0.83mol?L-1;
(3)二氧化硫能储存在某些装置中导致碱石灰吸收的二氧化硫减少,造成偏差,所以存在的缺陷是:缺少一个驱赶残留二氧化硫气体的装置,
故答案为:缺少一个驱赶残留二氧化硫气体的装置.
点评:本题考查了亚硫酸钠漂白性的探究实验,难度不大,注意实验室制取二氧化硫时选取的酸不能是浓盐酸、浓硝酸和98%的浓硫酸.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目