网址:http://m.1010jiajiao.com/timu3_id_145866[举报]
生产工程塑料PBT (![]() ) 的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。已知A为乙炔,B的所有原子均处于同一平面上。
) 的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。已知A为乙炔,B的所有原子均处于同一平面上。
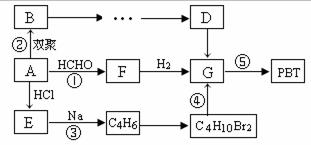
请结合下列所给信息,回答有关问题。
I. CH2=CH-CH=CH2与Br2的CCl4溶液发生1:1加成反应,可得到BrCH2-CH=CH-CH2Br和BrCH2-CHBr-CH=CH2两种产物。
II.2R-Cl + 2Na ![]() R-R + 2NaCl
R-R + 2NaCl
III.R1-C≡C-H+R2-CHO ![]()
![]() (R代表不同烃基或H)
(R代表不同烃基或H)
IV.R-C≡C-(CH2)n-CH=CH2+H2 ![]() R-CH=CH-(CH2)n-CH=CH2(n≥0)
R-CH=CH-(CH2)n-CH=CH2(n≥0)
(1)结构简式:E为_________________;F为___________________。
(2)反应⑤的化学反应方程式为:
____________________________________________________________________。
(3)请设计出自B→…→G的反应流程图(有机物用结构简式表示,须注明反应条件)。
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
![]()
 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4.该过程的化学方程式可表示为
(2)为测定过程中混合气的SO2体积分数,选用0.0500mol/LI2的标准溶液、淀粉溶液进行测定.已知:V(耗用I2标准溶液)=10.00mL,V(采集烟气)=100.0mL(已折算为标准状况),则烟气中SO2的体积分数为
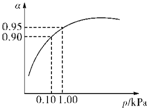
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示.试分析工业生产中采用常压的原因是
(4)在温度相同、体积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-98.3kJ?mol-1.
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2molSO2、1molO2 | 2molSO3 | mmolSO2、nmolO2、pmolSO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
 用:NaCl做原料可以得到多种产品.
用:NaCl做原料可以得到多种产品.(1)工业上由NaCl制备金属钠的化学方程式是
| ||
| ||
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液.写出阳极的电极反应方程式:
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液.为使Cl2被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
| ||
| ||
(10分)工业生产粗硅的反应有:
SiO2+2C Si(粗)+2CO↑;SiO2+3C
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) SiCl4(l); SiCl4+2H2
Si(纯)+4HCl。
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅:
若反应①为:Si(粗)+3HCl(g)SiHCl3(l)+H2(g);
则反应②的化学方程式为 ___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。
查看习题详情和答案>>
(10分)工业生产粗硅的反应有:
SiO2+2C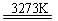 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C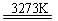 SiC+2CO↑。
SiC+2CO↑。
(1)若产品中粗硅与碳化硅的物质的量之比为1∶1,则参加反应的C 和SiO2的质量比为______________。
(2)粗硅进一步制备纯硅的原理如下:
Si(粗)+2Cl2(g) 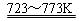 SiCl4(l); SiCl4+2H2
SiCl4(l); SiCl4+2H2  Si(纯)+4HCl。
Si(纯)+4HCl。
若上述反应中Si(粗 )和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂_______________吨。
(3)工业上还可以通过如下图所示的流程制取纯硅: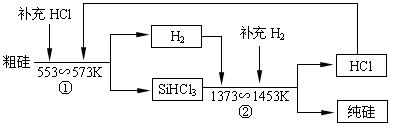
若反应①为:Si(粗)+3HCl(g)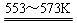 SiHCl3(l)+H2(g);
SiHCl3(l)+H2(g);
则反应②的化学方程式为___________________________________ 。
假设每一轮次生产过程中,硅元素没有损失,反应①中HCl的利用率为α1,反应②中H2的利用率为α2,,若制备1mol纯硅,在第二轮次的生产中,现补充投入HCl和H2的物质的量之比是5∶1。则α1与α2的代数关系式为____________________________。