摘要:13.常温下.其单质是有色气体的是 , 高一化学知识小卡片(35) 班 姓名 知识点:短周期元素推断题的常见“题眼 (一):
网址:http://m.1010jiajiao.com/timu3_id_145722[举报]
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是______;化合物丙中存在的作用力:______.
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是______.
③烧杯中溶液由无色变为红色,其原因______.(用电离方程式解释)
查看习题详情和答案>>
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是______;化合物丙中存在的作用力:______.
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是______.
③烧杯中溶液由无色变为红色,其原因______.(用电离方程式解释)
查看习题详情和答案>>

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是______;化合物丙中存在的作用力:______.
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是______.
③烧杯中溶液由无色变为红色,其原因______.(用电离方程式解释)
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是 ;化合物丙中存在的作用力: .
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是 .
③烧杯中溶液由无色变为红色,其原因 .(用电离方程式解释) 查看习题详情和答案>>

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是 ;化合物丙中存在的作用力: .
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是 .
③烧杯中溶液由无色变为红色,其原因 .(用电离方程式解释) 查看习题详情和答案>>
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;丙元素的原子结构中次外层电子数比最外层电子数多1;G是常见的金属单质,D在常温下为液态,H是一种黑色晶体。各物质间的转化关系如下图所示(反应条件多数已略去):请回答:
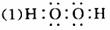
(1)甲、乙两种元素还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式为___________;
(2)实验室制取C的离子反应方程式为_____________;G与D在高温下反应的化学方程式为__________________________.
(3)B在C中燃烧的现象是_____________;在通常状况下,lgB在A中完全燃烧,生成液态D时,放出142.9kJ的热量,则表示B燃烧热的热化学方程式为_____________;
(4)以石墨为电极电解E的水溶液,其阳极反应式为_____________;
(5)实验室检验F的水溶液中所含金属阳离子的操作方法_____________.
查看习题详情和答案>>晶体硅是一种重要的非金属材料.请写出晶体硅的二种用途:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅.
已知:
Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:
Ⅱ.SiHCl3 在空气中自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)

①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④设计鉴定产品硅中是否含少量Fe单质的方法:
查看习题详情和答案>>
计算机芯片
计算机芯片
、太阳能电池
太阳能电池
.制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅.
已知:
Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:
SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑
SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑
.Ⅱ.SiHCl3 在空气中自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
.
| ||
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)

①装置B中的试剂是
浓H2SO4
浓H2SO4
,装置C中的烧瓶需要加热,其目的是使SiHCl3气化
使SiHCl3气化
;②反应一段时间后,装置D中观察到的现象是
D石英管的内壁附有灰黑色晶体
D石英管的内壁附有灰黑色晶体
,装置D中发生反应的化学方程式为SiHCl3+H2
Si+3HCl
| ||
SiHCl3+H2
Si+3HCl
;
| ||
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
先通一段时间H2,将装置中的空气排尽
先通一段时间H2,将装置中的空气排尽
;④设计鉴定产品硅中是否含少量Fe单质的方法:
取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
.