题目内容
常温下由三种短周期元素形成的气体单质X、Y、Z,并有下列转化关系(反应条件已略去):

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是______;化合物丙中存在的作用力:______.
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是______.
③烧杯中溶液由无色变为红色,其原因______.(用电离方程式解释)

已知:X分子中含共价键最多;甲分子中含10个电子,乙分子含有18个电子.
(1)写出X的结构式是______;化合物丙中存在的作用力:______.
(2)实验室中经常利用如图所示装置制备并收集甲(夹持、固定装置已略去但缺少收集装置).
请在如图方框内绘出用烧瓶收集甲的仪器装置简图(并将导管补充完整).
②试管中发生的化学反应方程式是______.
③烧杯中溶液由无色变为红色,其原因______.(用电离方程式解释)
根据图示信息可知,化合物丙是氯化铵,甲和乙是氯化氢和氨气中的一种,因为氨气是氮气和氢气化合而成的,氯化氢是氢气和氯气化合而成的,所以Y一定是氢气,X分子中含共价键最多,所以X是氮气,Z是氯气,甲是氨气,乙是氯化氢.
(1)氮气的结构式为:N≡N,氯化铵是离子晶体,其中的作用力是离子键,故答案为:N≡N;离子键;
(2)①氨气易溶于水,密度比空气小,用向下排空气法来收集,装置图为:
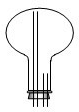
,故答案为:

;
②实验室中有氯化铵和氢氧化钙固体反应生成氨气的方法来制取氨气,发生的化学反应方程式是:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;
③氨气溶于水形成的氨水显碱性,能使酚酞显红色,因为NH3?H2O=NH4++OH-,故答案为:NH3?H2O=NH4++OH-.
(1)氮气的结构式为:N≡N,氯化铵是离子晶体,其中的作用力是离子键,故答案为:N≡N;离子键;
(2)①氨气易溶于水,密度比空气小,用向下排空气法来收集,装置图为:

,故答案为:

;
②实验室中有氯化铵和氢氧化钙固体反应生成氨气的方法来制取氨气,发生的化学反应方程式是:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
③氨气溶于水形成的氨水显碱性,能使酚酞显红色,因为NH3?H2O=NH4++OH-,故答案为:NH3?H2O=NH4++OH-.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出