网址:http://m.1010jiajiao.com/timu3_id_140186[举报]
能源、环境与人类的生活和社会发展密切相关.
(1)氢气是我们未来社会最理想的能源.氢气作燃料除燃烧时产生较多的热量外,另一个优点是 .
(2)目前,人类以化石燃料为主要能源,为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如图所示:
下列说法正确的是 (填序号).
①反应前后分子的种类没有改变
②反应前后所有元素的化合价都没有变化
③参加反应的A、B两物质的微粒个数比是1:3
④该反应是置换反应
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3完全燃烧生成水蒸气和空气中含量最多的气体,产物没有污染,且释放大量能量,有一定应用前景.
①NH3中氮元素和氢元素的质量比为 .
②写出NH3燃烧的化学方程式 .
能源、环境与人类的生活和社会发展密切相关.
(1)氢气是我们未来社会最理想的能源.氢气作燃料除燃烧时产生较多的热量外,另一个优点是 .
(2)目前,人类以化石燃料为主要能源,为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如图所示:
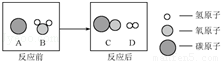
下列说法正确的是 (填序号).
①反应前后分子的种类没有改变
②反应前后所有元素的化合价都没有变化
③参加反应的A、B两物质的微粒个数比是1:3
④该反应是置换反应
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3完全燃烧生成水蒸气和空气中含量最多的气体,产物没有污染,且释放大量能量,有一定应用前景.
①NH3中氮元素和氢元素的质量比为 .
②写出NH3燃烧的化学方程式 .
查看习题详情和答案>>
(1)氢气是我们未来社会最理想的能源.氢气作燃料除燃烧时产生较多的热量外,另一个优点是 .
(2)目前,人类以化石燃料为主要能源,为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如图所示:

下列说法正确的是 (填序号).
①反应前后分子的种类没有改变
②反应前后所有元素的化合价都没有变化
③参加反应的A、B两物质的微粒个数比是1:3
④该反应是置换反应
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3完全燃烧生成水蒸气和空气中含量最多的气体,产物没有污染,且释放大量能量,有一定应用前景.
①NH3中氮元素和氢元素的质量比为 .
②写出NH3燃烧的化学方程式 .
(1)氢气是我们未来社会最理想的能源.氢气作燃料除燃烧时产生较多的热量外,另一个优点是
(2)目前,人类以化石燃料为主要能源,为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,其微观示意图如图所示:

下列说法正确的是
①反应前后分子的种类没有改变
②反应前后所有元素的化合价都没有变化
③参加反应的A、B两物质的微粒个数比是1:3
④该反应是置换反应
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3完全燃烧生成水蒸气和空气中含量最多的气体,产物没有污染,且释放大量能量,有一定应用前景.
①NH3中氮元素和氢元素的质量比为
②写出NH3燃烧的化学方程式
| ||
| ||
[提出问题]1.金属钠能否置换出硫酸铜溶液中的铜?2.金属钠能否在其他气体(如:CO2)中燃烧?
[查阅资料]金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
[实验探究]实验一:①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
[问题讨论](1)金属钠保存在煤油中的原因
(2)根据上述资料写出钠块投入水中所发生的反应方程式:
| ||
| ||
(3)实验二中生成的黑色颗粒是
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是Na2O,乙认为是Na2CO3,丙认为是Na2O和Na2CO3的混合物,丁认为是NaOH.
我认为认为丁的猜想是错误的,理由是
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有Na2O.
方案2:取该样品少量于试管里,滴加足量稀盐酸,溶液中有气泡冒出,结论:白色物质中一定有
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的
③评价与反思:大家认为实验方案1得出的结论不正确,其理由是
实验室中的金属钠着火时,你的灭火方法是
[拓展应用]小明同学为测定实验过程中所用的标示质量分数为32%的盐酸 (图1)的实际质量分数,他与小组的其他同学用pH测定仪组成实验装置(图2).实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加人该盐酸,测定仪打印出加入盐酸的质量与烧杯中溶液pH的关系图(图3).

①发生反应的化学方程式为:
②请以此次测定的结果,可计算出该盐酸的实际质量分数是
③请分析你的计算结果与标签标示的质量分数不一致的可能原因: