摘要: MnO2 (1)① 两个铁原子 ② Na+ ③ 7 (2)① 4P+5022P205 ②2H2O2======2H2O +O2↑ (3)① N2 ② 14:3
网址:http://m.1010jiajiao.com/timu3_id_133135[举报]
12、除去下列物质中所含少量 杂质,所用除杂试剂和提纯方法正确的是( )
|
查看习题详情和答案>>
探究红砖粉未和二氧化锰加速过氧化氢分解速率不同,进行下列实验:
分别称取5.0g红砖粉未和5.0g二氧化锰,分别与100g相同质量分数的过氧化氢溶液混合,进行下列测定,经数据处理后得到反应生成的氧气质量与反应时间的关系(如图所示).
(1)在2H2O2
2H2O+O2↑反应中,你认为选用催化剂是选择MnO2,还是红砖粉未?
(2)100g过氧化氢溶液含过氧化氢多少克?(不考虑其它因素,计算结果精确至0.1)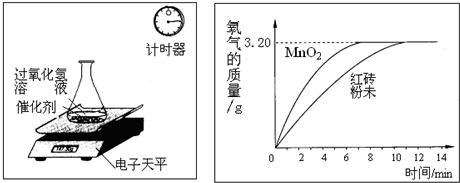
查看习题详情和答案>>
分别称取5.0g红砖粉未和5.0g二氧化锰,分别与100g相同质量分数的过氧化氢溶液混合,进行下列测定,经数据处理后得到反应生成的氧气质量与反应时间的关系(如图所示).
(1)在2H2O2
| 催化剂 |
MnO2
MnO2
.(2)100g过氧化氢溶液含过氧化氢多少克?(不考虑其它因素,计算结果精确至0.1)

22、现用下列装置制取初中常见的气体.请回答.
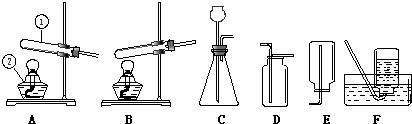
(1)写出仪器①、②的名称:①是
(2)用高锰酸钾制氧气时,应选用的发生装置
(3)利用C装置,通过分解反应可制得的气体是(写化学式)
(4)利用C装置,通过复分解反应可制得的气体是(写化学式)
(5)检验装置A气密性的具体方法是
查看习题详情和答案>>

(1)写出仪器①、②的名称:①是
试管
,②是酒精灯
.(2)用高锰酸钾制氧气时,应选用的发生装置
A
,该反应的化学方程式为2KMnO4=K2MnO4+MnO2+O2↑
.(3)利用C装置,通过分解反应可制得的气体是(写化学式)
O2
,该反应的化学方程式为2H2O2═2H2O+O2↑
,其收集装置应选用D或F
(填编号).(4)利用C装置,通过复分解反应可制得的气体是(写化学式)
CO2
,其收集装置应选用D
(填编号).(5)检验装置A气密性的具体方法是
将其导管口一端浸入水中,再用手紧握住试管,如果水中产生少量气泡,说明气密性良好
.以下是某研究小组探究影响反应速率部分因素的相关实验数据.
(1)通过实验①和②对比可知,化学反应速率与
(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
查看习题详情和答案>>
| 实验序号 | H2O2溶 液浓度% |
H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
反应物浓度
反应物浓度
有关;从实验③
③
和④
④
对比可知,化学反应速率与温度的关系是:温度越高,化学反应速率越快
温度越高,化学反应速率越快
;(2)化学反应的实质是微观粒子相互接触、碰撞的结果,化学反应速率与微观粒子的概率有关.试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因是:
反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快
反应物浓度越大,单位体积的反应物中含有的粒子数越多,粒子间碰撞的概率越大,化学反应速率越快
.