题目内容
探究红砖粉未和二氧化锰加速过氧化氢分解速率不同,进行下列实验:
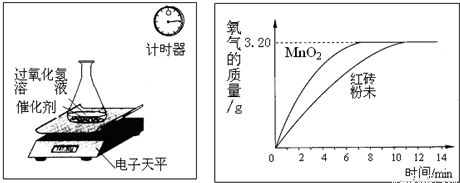
分别称取5.0g红砖粉未和5.0g二氧化锰,分别与100g相同质量分数的过氧化氢溶液混合,进行下列测定,经数据处理后得到反应生成的氧气质量与反应时间的关系(如图所示).
(1)在2H2O2
2H2O+O2↑反应中,你认为选用催化剂是选择MnO2,还是红砖粉未?
(2)100g过氧化氢溶液含过氧化氢多少克?(不考虑其它因素,计算结果精确至0.1)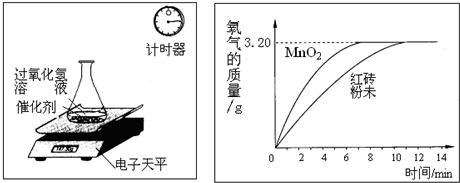
分别称取5.0g红砖粉未和5.0g二氧化锰,分别与100g相同质量分数的过氧化氢溶液混合,进行下列测定,经数据处理后得到反应生成的氧气质量与反应时间的关系(如图所示).
(1)在2H2O2
| 催化剂 |
MnO2
MnO2
.(2)100g过氧化氢溶液含过氧化氢多少克?(不考虑其它因素,计算结果精确至0.1)

分析:(1)依据图象中两者的催化作用效果分析解答即可
(2)依据根据生成气体的质量与反应时间的关系图可知,所取过氧化氢完全反应放出氧气质量为3.2g,利用反应放出氧气的质量根据化学方程式可计算所取溶液中过氧化氢的质量.
(2)依据根据生成气体的质量与反应时间的关系图可知,所取过氧化氢完全反应放出氧气质量为3.2g,利用反应放出氧气的质量根据化学方程式可计算所取溶液中过氧化氢的质量.
解答:解:(1)由图象的信息可知二氧化锰的催化效果较明显,反应所用的时间较短,而红砖粉未催化效果不很明显,反应所用的时间较长,所以在该反应中还是采用二氧化锰较为合适;
(2)根据生成气体的质量与反应时间的关系图可知,所取过氧化氢完全反应放出氧气质量为3.2g,
设100g过氧化氢溶液中溶质的质量为x.
2H2O2
2H2O+O2↑
68 32
x 3.2g
=
x=6.8g
故答案为:(1)MnO2 ;(2)答:该过氧化氢溶液中溶质的质量为6.8g.
(2)根据生成气体的质量与反应时间的关系图可知,所取过氧化氢完全反应放出氧气质量为3.2g,
设100g过氧化氢溶液中溶质的质量为x.
2H2O2
| ||
68 32
x 3.2g
| 68 |
| x |
| 32 |
| 3.2g |
x=6.8g
故答案为:(1)MnO2 ;(2)答:该过氧化氢溶液中溶质的质量为6.8g.
点评:本题难度不是很大,理解图形分析反应的进程、抓住“三点一趋势”(起点、拐点、终点和图象的变化趋势)、分析图象中所给数据的含义、正确的运用有关数据解决问题是解答此类题目的关键所在.

练习册系列答案
相关题目
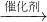 2H2O+O2↑反应中,你认为选用催化剂是选择MnO2,还是红砖粉未?______.
2H2O+O2↑反应中,你认为选用催化剂是选择MnO2,还是红砖粉未?______.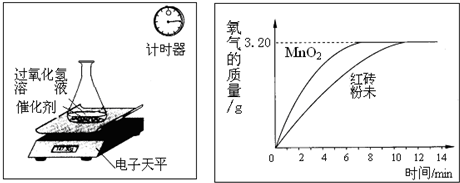
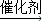 2H2O+O2↑反应中,你认为选用催化剂是选择MnO2,还是红砖粉未?______.
2H2O+O2↑反应中,你认为选用催化剂是选择MnO2,还是红砖粉未?______.