摘要:26. 利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如.在一定量的待测酸溶液中逐滴滴入已知质量分数的碱溶液(这种溶液被称为标准溶液).直到酸.碱恰好完全反应.根据消耗标准碱溶液的多少即可求算出待测酸溶液的溶质质量分数. 右下图为某次测定过程中.溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图. (1)根据右下图曲线可以判断在实验中是向 溶液中滴加 溶液. (2)在这次测定中.为了指示中和反应刚好完全.用酚酞做指示剂.即在待测溶液中先滴入几滴酚酞试液.若看到 现象.则证明中和反应刚好完全. (3)如果实验中使用的酸是硫酸溶液.碱是氢氧化钠溶液.且待测液和标准液的密度均以
网址:http://m.1010jiajiao.com/timu3_id_12539[举报]
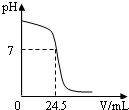 利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或
利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或碱)溶液中逐滴加入已知质量分数的碱(或酸)溶液(标准溶液),直到酸、碱正好完全反应,根据消耗标准碱(或酸)溶液的多少即可求算出待测酸(或碱)溶液的质量分数.
右图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.
(1)根据图曲线可以判断实验中是向
(2)在这次测定中,为了指示中和反应刚好完全,用酚酞作指示剂,即在待测溶液中先滴入几滴酚酞试液,若看到
(3)如果实验中使用的酸是硫酸,碱是氢氧化钠,且待测液和标准液的密度均以1.0g/mL计.若测定中取用待测液25mL,标准液溶质的质量分数为4.5%,根据图中数据,计算待测液溶质的质量分数. 查看习题详情和答案>>
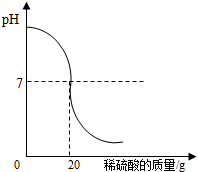 利用中和反应可以测定酸或碱溶液中溶质的质量分数.为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液25g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如下图所示.计算:
利用中和反应可以测定酸或碱溶液中溶质的质量分数.为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液25g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如下图所示.计算:(1)所取氢氧化钠溶液中溶质的质量分数.
(2)当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.
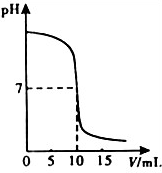 利用中和反应可以测定酸或碱溶液中溶质的质量分数.右下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.
利用中和反应可以测定酸或碱溶液中溶质的质量分数.右下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.(1)根据右下图曲线可以判断该实验操作是将
酸溶液
酸溶液
滴加到另一种溶液中.(2)如果实验中使用的酸是硫酸溶液,碱是氢氧化钠,溶液取氢氧化钠溶液25g,向其中加入溶质的质量分数为9.8%的稀硫酸,加入稀硫酸质量与pH的变化情况如下图所示.计算:①所取氢氧化钠溶液中溶质的质量分数.②当两者完全反应时,所得溶液中溶质的质量分数. (计算结果精确到0.1%)
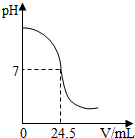 利用中和反应可以测定酸或碱溶液中溶质的质量分数.如图为某次测定过程中溶液的pH随所滴加的某标准溶液体积变化而变化的关系图.
利用中和反应可以测定酸或碱溶液中溶质的质量分数.如图为某次测定过程中溶液的pH随所滴加的某标准溶液体积变化而变化的关系图.