题目内容
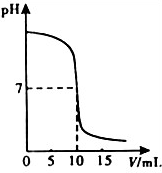 利用中和反应可以测定酸或碱溶液中溶质的质量分数.右下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.
利用中和反应可以测定酸或碱溶液中溶质的质量分数.右下图为某次测定过程中,溶液的pH随所滴加的某标准溶液体积的变化而变化的关系图.(1)根据右下图曲线可以判断该实验操作是将
酸溶液
酸溶液
滴加到另一种溶液中.(2)如果实验中使用的酸是硫酸溶液,碱是氢氧化钠,溶液取氢氧化钠溶液25g,向其中加入溶质的质量分数为9.8%的稀硫酸,加入稀硫酸质量与pH的变化情况如下图所示.计算:①所取氢氧化钠溶液中溶质的质量分数.②当两者完全反应时,所得溶液中溶质的质量分数. (计算结果精确到0.1%)
分析:根据图中所示可知,开始时溶液的pH大于7,显碱性,是向碱溶液中滴加酸溶液,恰好完全反应时,溶液呈中性,酚酞呈无色,根据化学方程式可以进行相关的计算.
解答:解:(1)根据溶液的pH变化情况可知,开始时溶液的pH大于7,显碱性,后来溶液的pH小于7,是向碱溶液中滴加酸溶液;
(2)解:设待测液溶质的质量分数为x,生成的硫酸钠的质量为y.
2NaOH+H2SO4═Na2SO4+2H2O
80 98 142
25g×x 10g×9.8% y
=
x=3.2%
=
y=1.42g
所得溶液中溶质的质量分数=
×100%=4.1%
答:待测液溶质的质量分数为3.2%,所得溶液中溶质的质量分数4.1%.
故答案为:(1)酸溶液;(2)①3.2%;②4.1%.
(2)解:设待测液溶质的质量分数为x,生成的硫酸钠的质量为y.
2NaOH+H2SO4═Na2SO4+2H2O
80 98 142
25g×x 10g×9.8% y
| 80 |
| 25g×x |
| 98 |
| 10g×9.8% |
x=3.2%
| 98 |
| 10g×9.8% |
| 142 |
| y |
y=1.42g
所得溶液中溶质的质量分数=
| 1.42g |
| 25g+10g |
答:待测液溶质的质量分数为3.2%,所得溶液中溶质的质量分数4.1%.
故答案为:(1)酸溶液;(2)①3.2%;②4.1%.
点评:本题主要考查根据图识别问题,根据化学方程式进行相关计算的问题,难度较大,要认真仔细解答.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
 利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或
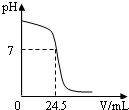
利用中和反应可以测定酸或碱溶液中溶质的质量分数.例如,在一定量的待测酸(或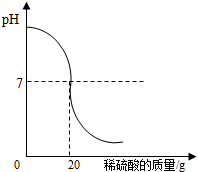 利用中和反应可以测定酸或碱溶液中溶质的质量分数.为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液25g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如下图所示.计算:
利用中和反应可以测定酸或碱溶液中溶质的质量分数.为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液25g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如下图所示.计算: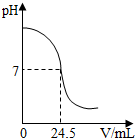 (2013?昆山市一模)利用中和反应可以测定酸或碱溶液中溶质的质量分数.如图为某次测定过程中溶液的pH随所滴加的某标准溶液体积变化而变化的关系图.
(2013?昆山市一模)利用中和反应可以测定酸或碱溶液中溶质的质量分数.如图为某次测定过程中溶液的pH随所滴加的某标准溶液体积变化而变化的关系图.