摘要:[化学--选修化学与技术] 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: 依据上图.完成下列填空: (1) 在电解过程中.与电源正极相连的电极上所发生反应的方程式为: . 与电源负极相连的电极附近溶液pH .(填“不变 “增大 或“减小 ) (2)如果粗盐中SO42-含量较高.必须添加钡试剂除去SO42-.该试剂可以选 . a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2 (3)为有效除去Ca2+.Mg2+.SO42-.加入试剂的合理顺序为 (选a.b.c.多选扣分). a.先加NaOH.后加Na2CO3.再加钡试剂 b.先加NaOH.后加钡试剂.再加Na2CO3 c.先加钡试剂.后加NaOH.再加Na2CO3 (4)在用阳离子交换膜法电解食盐水时.电解槽分隔为阳极区和阴极区.防止Cl2与NaOH反应,采用无隔膜电解冷的食盐水时.Cl2与NaOH充分反应.产物最终仅有NaClO和H2.相应的化学反应方程式为 . .
网址:http://m.1010jiajiao.com/timu3_id_1240877[举报]
【化学_选修2化学与技术】
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
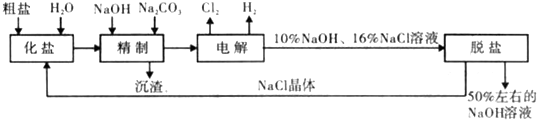
(1)在电解过程中,阳极的电极反应式为 与电源负极相连的电极附近.溶液pH 值 (选填“不变“、“升髙“或“下降“)
(2)铕制饱和食盐水时,为有效除去Ca2+、Mg2+、SO
,加入除杂试剂的合理顺序为 (选填a,b,c多选扣分),沉淀过滤后再加入HCl.
a.先加 NaOH,后加 Na2CO,再加 BaCl2 b.先加 NaOH,后加 BaCl2,再加 Na2CO3,
c.先加BaCl2,后加NaOH,再加Na2CO,d.先加Na2CO3,后加BaCl2,再加NaOH
写出沉淀过滤后,加入HCl时发生反应的离子方程式 .
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅含一种溶质,相应的化学方程式为
(4)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4生产NaOH和H2SO4溶液的装置.从F口可不断充入Na2SO4.

请分析:①a为 (填“阳“或“阴“)离子交换膜;
②从D 口流出的溶液为 .(填溶质化学式)
查看习题详情和答案>>
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

(1)在电解过程中,阳极的电极反应式为
(2)铕制饱和食盐水时,为有效除去Ca2+、Mg2+、SO
2- 4 |
a.先加 NaOH,后加 Na2CO,再加 BaCl2 b.先加 NaOH,后加 BaCl2,再加 Na2CO3,
c.先加BaCl2,后加NaOH,再加Na2CO,d.先加Na2CO3,后加BaCl2,再加NaOH
写出沉淀过滤后,加入HCl时发生反应的离子方程式
(3)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅含一种溶质,相应的化学方程式为
(4)如图是根据氯碱工业中离子交换膜技术原理设计的电解Na2SO4生产NaOH和H2SO4溶液的装置.从F口可不断充入Na2SO4.

请分析:①a为
②从D 口流出的溶液为
[化学一选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10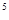 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________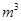 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水, 若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
(5)工程塑料ABS合成时,用了以下三种单体: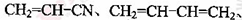 、
、 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
[化学一选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
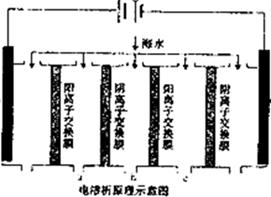
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10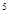 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________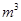 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水, 若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
(5)工程塑料ABS合成时,用了以下三种单体: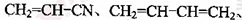 、
、
 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。

①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10
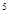 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________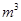 。
。(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水, 若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
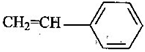
(5)工程塑料ABS合成时,用了以下三种单体:
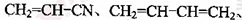 、
、 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。[化学--选修化学与技术]
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
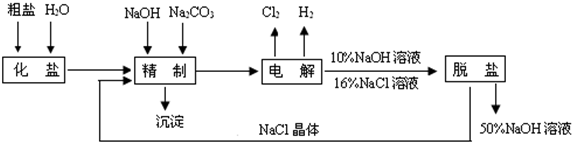
依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的方程式为: .与电源负极相连的电极附近溶液pH .(填“不变”“增大”或“减小”)
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该试剂可以选 .
a.Ba(OH)2 b.Ba(NO3)2c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选a、b、c,多选扣分).
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)在用阳离子交换膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分反应,产物最终仅有NaClO和H2,相应的化学反应方程式为 、 .
查看习题详情和答案>>
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据如图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的方程式为:
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该试剂可以选
a.Ba(OH)2 b.Ba(NO3)2c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)在用阳离子交换膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分反应,产物最终仅有NaClO和H2,相应的化学反应方程式为