题目内容
[化学一选修2:化学与技术](15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子氧化为溴单质,则处理l.0×10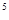 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________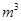 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水, 若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
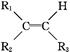
(5)工程塑料ABS合成时,用了以下三种单体: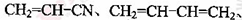 、
、 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
(1)蒸馏法(1分) 离子交换法 (1分)
(2)① 4OH― -4e- = 2H2O+O2 ↑ (2分)
② b (2分)
③ 9.52 (2分)
(3)2 Fe3+ + 3 ClO― + 10 OH― ="2" FeO42- + 3 Cl― + 5 H2O (2分)
(4)阳 (1分);
Mg2+ + 2Cl― + 2H2O  Cl2 ↑+ H2 ↑ + Mg(OH)2 ↓ (2分)
Cl2 ↑+ H2 ↑ + Mg(OH)2 ↓ (2分)
(5) 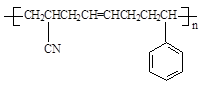 (2分)
(2分)
解析试题分析:(1)海水的淡化常用的方法有蒸馏法、离子交换法、电渗析法等;
(2)①阳极是阴离子放电,所以阳极是氢氧根离子放电生成氧气,电极反应式为4OH― -4e- = 2H2O+O2 ↑②在电场作用下,海水的阳离子趋向阴极,阴离子趋向阳极,但阳离子只能透过阳膜,却被相邻的阴膜阻挡,阴离子与此相反,所以淡水从b口出;
③l.0×10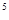 L该浓海水中含有溴元素的物质的量是l.0×10
L该浓海水中含有溴元素的物质的量是l.0×10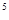 L×0.68g/L÷80g/mol,需要氯气标准状况下的体积是l.0×10
L×0.68g/L÷80g/mol,需要氯气标准状况下的体积是l.0×10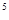 L×0.68g/L÷80g/mol÷2×22.4L/mol=9520L=9.52m3;
L×0.68g/L÷80g/mol÷2×22.4L/mol=9520L=9.52m3;
(3)根据氧化还原反应理论,Fe(NO3)3溶液与浓KClO溶液在强碱性中生成K2FeO4及氯化钾、水,离子方程式为2 Fe3+ + 3 ClO― + 10 OH― ="2" FeO42- + 3 Cl― + 5 H2O;
(4)氯碱工业常用阳离子交换膜电解槽电解精制的饱和食盐水,若盐水中含有杂质MgCl2,镁离子通过阳离子交换膜与阴极的氢氧根离子结合生成氢氧化镁沉淀堵塞离子交换膜,发生的离子方程式为 Mg2++2Cl―+2H2O Cl2↑+ H2↑+Mg(OH)2↓
Cl2↑+ H2↑+Mg(OH)2↓
(5)CH2=CH-CN与苯乙烯中含有1个碳碳双键,而1,3-丁二烯中含有2个碳碳双键,所以三者发生加聚反应时1,3-丁二烯中的碳碳双键断裂分别与CH2=CH-CN与苯乙烯中碳碳双键发生加成聚合反应,所以 产物的结构简式为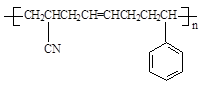
考点:考查海水的淡化技术,对装置原理的判断,电化学理论的应用,加聚产物的判断

DAP是电器和仪表部件中常用的一种高分子化合物,其结构简式为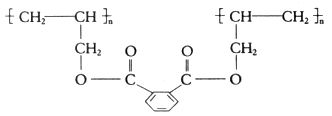
合成它的单体可能有:①邻苯二甲酸 ②丙烯醇 ③丙烯 ④乙烯 ⑤邻苯二甲酸甲酯,正确的一组是
| A.仅①② | B.仅④⑤ | C.仅①③ | D.仅③④ |
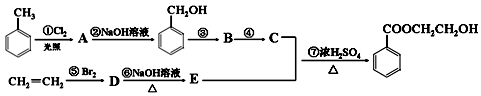
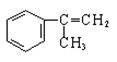
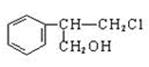

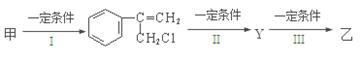
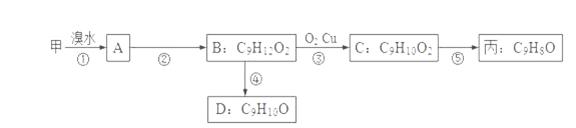
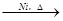




 R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
R—CH2CH2OH;③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
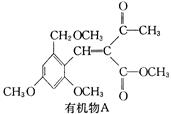
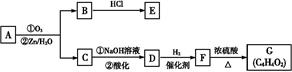
 CH2制得有机物A的化学方程式为 ,反应类型是 。
CH2制得有机物A的化学方程式为 ,反应类型是 。 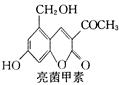
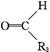
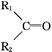 +
+
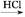 R—OH(R为脂肪烃或芳香烃的烃基)
R—OH(R为脂肪烃或芳香烃的烃基)