摘要:①碱性氧化物+酸→盐+H2O ②碱+酸→盐+H2O ③酸+盐→新盐+新酸 ④盐1+盐2→新盐1+新盐2 ⑤盐+碱→新盐+新碱
网址:http://m.1010jiajiao.com/timu3_id_123555[举报]
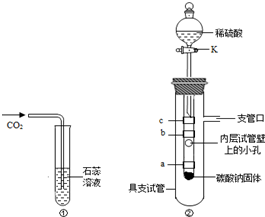
学完“二氧化碳性质的探究”后,小明同学觉得按照实验
(图①)不能完全说明是什么物质使紫色石蕊溶液变红色,他和小娜同学进行了如下实验探究:
【猜想与假设】
猜想一:水使紫色石蕊溶液变红
猜想二:二氧化碳使紫色石蕊溶液变红猜想三:二氧化碳与水反应生成的新物质使紫色石蕊溶液变红
【查阅资料与实验准备】
将纸条浸泡在紫色石蕊溶液中,晾干后可制得紫色石蕊试纸.
自制的紫色石蕊试纸遇酸变红色,遇碱溶液变蓝色.
【设计与实验】
小明同学设立了实验装置如图②.
图中a、b、c为紫色石蕊试纸,缠绕在小试管上,其中a和c用水湿润.
(1)a、c石蕊试纸用水润湿后仍为紫色,说明猜想
(2)打开活塞K,滴入稀硫酸,发生反应的方程式为
观察并解释实验现象:
①试纸b没有明显变化,得出结论:猜想
②试纸a、c由紫色变为红色,得出结论:猜想
③试纸
【交流与反思】
(3)小娜同学认为,上图装置还可以同时验证:A.二氧化碳能使澄清石灰水变浑浊;B.二氧化碳不能燃烧不支持燃烧.
为了分别完成小娜同学的两个验证实验,请对上面的实验进行简单的改进:
A.
(4)该实验不用盐酸而用硫酸是为了防止HCl气体对试纸变色的干扰;试分析此实验用碳酸钠而不用大理石的原因
查看习题详情和答案>>
(图①)不能完全说明是什么物质使紫色石蕊溶液变红色,他和小娜同学进行了如下实验探究:

【猜想与假设】
猜想一:水使紫色石蕊溶液变红
猜想二:二氧化碳使紫色石蕊溶液变红猜想三:二氧化碳与水反应生成的新物质使紫色石蕊溶液变红
【查阅资料与实验准备】
将纸条浸泡在紫色石蕊溶液中,晾干后可制得紫色石蕊试纸.
自制的紫色石蕊试纸遇酸变红色,遇碱溶液变蓝色.
【设计与实验】
小明同学设立了实验装置如图②.
图中a、b、c为紫色石蕊试纸,缠绕在小试管上,其中a和c用水湿润.
(1)a、c石蕊试纸用水润湿后仍为紫色,说明猜想
一
一
不正确.(2)打开活塞K,滴入稀硫酸,发生反应的方程式为
Na2CO3+H2SO4═Na2SO4+H2O+CO2
Na2CO3+H2SO4═Na2SO4+H2O+CO2
.观察并解释实验现象:
①试纸b没有明显变化,得出结论:猜想
二
二
不正确.②试纸a、c由紫色变为红色,得出结论:猜想
三
三
正确.相关化学方程式为H2O+CO2═H2CO3
H2O+CO2═H2CO3
.③试纸
a
a
首先变色,其原因是CO2密度大于空气
CO2密度大于空气
.【交流与反思】
(3)小娜同学认为,上图装置还可以同时验证:A.二氧化碳能使澄清石灰水变浑浊;B.二氧化碳不能燃烧不支持燃烧.
为了分别完成小娜同学的两个验证实验,请对上面的实验进行简单的改进:
A.
具支试管中倒入少量澄清石灰水
具支试管中倒入少量澄清石灰水
;B.支管口放一燃着的木条进行验证二氧化碳是否具有可燃性
支管口放一燃着的木条进行验证二氧化碳是否具有可燃性
.(4)该实验不用盐酸而用硫酸是为了防止HCl气体对试纸变色的干扰;试分析此实验用碳酸钠而不用大理石的原因
碳酸钙会与硫酸生成微溶的硫酸钙覆盖在表面阻碍反应进行
碳酸钙会与硫酸生成微溶的硫酸钙覆盖在表面阻碍反应进行
(写一点).(2013?广东模拟)实验室有一瓶敞放着的氢氧化钠固体,同学们想探究这瓶固体的成分,请你一同参与探究并回答有关问题.
请你写出氢氧化钠在空气中变质的化学方程式:
提出猜想:
猜想1:这瓶固体的成分是NaOH;
猜想2:这瓶固体的成分是Na2CO3;
猜想3:这瓶固体的成分是
实验与结论:
(1)取少量样品于试管中,加入适量蒸馏水,振荡,样品全部溶于水,向其中加入无色酚酞溶液,溶液由无色变成红色.甲同学认为这瓶固体含有NaOH,猜想1正确.乙同学认为甲同学的结论不正确,其理由是
(2)向(1)溶液中加入过量的CaCl2溶液,生成白色沉淀,沉淀后静置,溶液由红色变成无色.同学们认为猜想
问题讨论:
(1)丙同学认为实验时也可以先加入过量的CaCl2溶液,振荡、静置,然后在上层清液中加入无色酚酞溶液,你认为丙同学的说法
(2)丁同学认为CaCl2溶液也可以改为Ca(OH)2溶液,你认为丁同学的说法
查看习题详情和答案>>
请你写出氢氧化钠在空气中变质的化学方程式:
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
,可加入试剂稀盐酸
稀盐酸
,如有气泡产生则氢氧化钠变质.提出猜想:
猜想1:这瓶固体的成分是NaOH;
猜想2:这瓶固体的成分是Na2CO3;
猜想3:这瓶固体的成分是
NaOH和Na2CO3混合物
NaOH和Na2CO3混合物
.实验与结论:
(1)取少量样品于试管中,加入适量蒸馏水,振荡,样品全部溶于水,向其中加入无色酚酞溶液,溶液由无色变成红色.甲同学认为这瓶固体含有NaOH,猜想1正确.乙同学认为甲同学的结论不正确,其理由是
Na2CO3的水溶液也呈碱性
Na2CO3的水溶液也呈碱性
.(2)向(1)溶液中加入过量的CaCl2溶液,生成白色沉淀,沉淀后静置,溶液由红色变成无色.同学们认为猜想
2
2
是正确的.问题讨论:
(1)丙同学认为实验时也可以先加入过量的CaCl2溶液,振荡、静置,然后在上层清液中加入无色酚酞溶液,你认为丙同学的说法
正确
正确
(选填“正确”或“不正确”),此时反应的化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
;若猜想3正确,则现象为有白色沉淀生成,上层清液变红
有白色沉淀生成,上层清液变红
,其中无色酚酞溶液还可用一种盐溶液,如CuCl2
CuCl2
(写化学式)来代替验证猜想.(2)丁同学认为CaCl2溶液也可以改为Ca(OH)2溶液,你认为丁同学的说法
不正确
不正确
(选填“正确”或“不正确”),理由是会生成新的NaOH,无法检验原来样品中的NaOH
会生成新的NaOH,无法检验原来样品中的NaOH
.(2012?黄浦区二模)选择“低碳生活”,减少二氧化碳排放,是每位公民应尽的责任和义务.
①生活中少用10个塑料袋可以减少约0.02molCO2排放.CO2的摩尔质量是
②“低碳交通”鼓励使用新能源,氢能是最清洁的能源,写出氢气燃烧的化学方程式
③回收可利用的资源,如旧手机中的金属.手机机芯中含有铜、金、银等.写出银的化学式
Ⅰ.氧化铜与盐酸反应的化学方程式是
Ⅱ.溶液A的溶质组成是
Ⅲ.在固体B中加入过量的
查看习题详情和答案>>
①生活中少用10个塑料袋可以减少约0.02molCO2排放.CO2的摩尔质量是
44 g/mol
44 g/mol
;它属于酸性
酸性
氧化物(填“酸性”或“碱性”). 0.02molCO2约含有1.204×1022
1.204×1022
个CO2分子.②“低碳交通”鼓励使用新能源,氢能是最清洁的能源,写出氢气燃烧的化学方程式
2H2+O2
2H2O
| ||
2H2+O2
2H2O
.
| ||
③回收可利用的资源,如旧手机中的金属.手机机芯中含有铜、金、银等.写出银的化学式
Ag
Ag
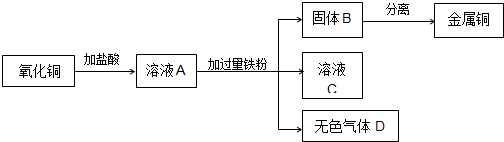
.下图是实验室制取金属铜的流程图:
Ⅰ.氧化铜与盐酸反应的化学方程式是
CuO+2HCl═CuCl2+H2O
CuO+2HCl═CuCl2+H2O
.Ⅱ.溶液A的溶质组成是
CuCl2、HCl
CuCl2、HCl
.Ⅲ.在固体B中加入过量的
HCl或CuCl2
HCl或CuCl2
溶液,再通过过滤
过滤
的分离方法得到金属铜.(2013?朝阳区一模)课外小组同学用实验证明“二氧化碳与水接触时才能和过氧化钠反应”.
(1)实验准备
查阅资料
①过氧化钠能与水、二氧化碳,盐酸反应,反应过程中均有氧气放出.
过氧化钠与二氧化碳反应时,除生成氧气外,还生成一种工业上制玻璃的原料,写出该反应的化学方程式
②CO2能与碳酸钠水溶液反应生成碳酸氢钠,CO2在饱和的碳酸氢钠溶液中几乎不溶解.
设计方案
①小组同学设计了如图1所示的实验装置.

②老师指出,应在M点前增加下列
(2)实验过程
①连接仪器,检查装置的气密性,将K1、K2关闭;
②向装置中分别加入所需药品,写出装置Ⅰ中发生反应的化学方程式
③实验时,先打开
④实验过程中观察到带火星的木条始终不复燃.
(3)实验分析
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是
②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2与Na2O2发生反应,原因是
(4)实验反思
丙同学认为:应进一步证明CO2与Na2O2反应生成新物质.他补充的实验是:取Ⅲ中反应后所得固体滴加稀盐酸,产生大量气泡,则证明有新物质生成.
丁同学认为:丙同学实验时应将产生气体通入澄清石灰水,否则不能证明CO2与Na2O2反应,其理由是
查看习题详情和答案>>
(1)实验准备
查阅资料
①过氧化钠能与水、二氧化碳,盐酸反应,反应过程中均有氧气放出.
过氧化钠与二氧化碳反应时,除生成氧气外,还生成一种工业上制玻璃的原料,写出该反应的化学方程式
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.②CO2能与碳酸钠水溶液反应生成碳酸氢钠,CO2在饱和的碳酸氢钠溶液中几乎不溶解.
设计方案
①小组同学设计了如图1所示的实验装置.

②老师指出,应在M点前增加下列
C
C
装置(如图2),才能得到更准确的实验结论.(2)实验过程
①连接仪器,检查装置的气密性,将K1、K2关闭;
②向装置中分别加入所需药品,写出装置Ⅰ中发生反应的化学方程式
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.③实验时,先打开
K2
K2
(填K1或K2 ),将带火星的木条置于a口处,一段时间后,关闭它,再打开另一个弹簧夹,再将带火星的木条置于a口处.④实验过程中观察到带火星的木条始终不复燃.
(3)实验分析
①为观察到最终木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是
除去未充分反应的CO2
除去未充分反应的CO2
;②乙认为即使采纳甲的建议且最终观察到木条复燃,也不能证明CO2与Na2O2发生反应,原因是
水与Na2O2反应生成氧气
水与Na2O2反应生成氧气
.(4)实验反思
丙同学认为:应进一步证明CO2与Na2O2反应生成新物质.他补充的实验是:取Ⅲ中反应后所得固体滴加稀盐酸,产生大量气泡,则证明有新物质生成.
丁同学认为:丙同学实验时应将产生气体通入澄清石灰水,否则不能证明CO2与Na2O2反应,其理由是
Ⅲ中固体含有未反应完全的Na2O2,与稀盐酸反应会产生O2,不能确认Na2CO3的存在
Ⅲ中固体含有未反应完全的Na2O2,与稀盐酸反应会产生O2,不能确认Na2CO3的存在
.
某中学同学学完第十一单元后,在教师的指导下对“酸、碱、盐之间并不是都能发生复分解反应,发生复分解反应应具备哪些条件?”设计了如下科学探究活动.
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
(4)解释与结论:
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有 ,⑤中有 ,从而使化学反应得以发生.经过分析,同学们得出的结论,猜想 正确.
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“ ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.

(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
t℃时表中四种化合物在溶剂A中发生复分解反应的化学方程式为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2,则表中四种化合物中某两种化合物在溶剂B中发生复分解反应的化学方程式为 .
查看习题详情和答案>>
(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
| 实验步骤 | 实验现象 | 化学反应方程式 |
| ①硝酸钡溶液中滴加稀硫酸 | H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 | |
| ②稀硫酸溶液中滴加碳酸钾溶液 | H2SO4+K2CO3=K2SO4+CO2↑+H2O | |
| ③稀盐酸溶液中先加2滴酚酞试液再滴加氢氧化钠溶液 | 溶液由无色变浅红色,并不褪色 | |
| ④硝酸钡溶液中滴加碳酸钾溶液 | 有白色沉淀 | |
| ⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,并用湿的红石蕊试纸检验生成的气体 | 有无色、刺激性气味的气体生成,该气体能使湿的红石蕊试纸变蓝 |
上述反应为什么能够发生?是因为在这些反应物中有特殊的阴、阳离子,它们两两结合生成了沉淀或气体或水.如①中有Ba2++SO42-→BaSO4↓,②中有H++CO32-→H2O+CO2↑,③中有H++OH-→H2O,④中有
(5)形成网络:按照一定的顺序排列某些离子,就可以形成一个知识网络.在网络中,用“---”相连接的阴、阳离子之间能两两结合生成沉淀或气体或水.现有Ca2+、HCO3-、NH4+三种离子,请将它们填入合适的“
 ”内,使其形成一个更完整的复分解反应的知识网络.
”内,使其形成一个更完整的复分解反应的知识网络.
(6)拓展应用:根据得出的结论,解决以下问题:
t℃时四种化合物在溶剂A和溶剂B的溶解度如下表:
| 物质 | 在溶剂A中的溶解度/g | 在溶剂B中的溶解度/g |
| AgNO3 | 170 | 86 |
| Ba(NO3)2 | 9.3 | 97.2 |
| AgCl | 1.5×10-4 | 0.8 |
| BaCl2 | 33.3 | 约为0 |