摘要:酸:大多数溶
网址:http://m.1010jiajiao.com/timu3_id_123465[举报]
酸陛重铬酸钾(K2Cr207)有强氧化性,易将酒精(C2H5OH)氧化,生成的硫酸铬呈绿色.这是广大交警判断司机是否饮酒的一种方法,反应方程式如下:2K2Cr2O7+3C2H5OH+8H2S04═2Cr2(S04)3+3CH3COOH+2K2S04+11H20.现有100g量分数为58.8%的重铬酸钾溶液,可用来检测多少克酒精?
查看习题详情和答案>>
 酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.
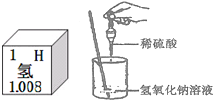
酸、碱、盐是初中化学学习的重要内容,同学们在实验室对酸、碱、盐的性质进行探究.(1)酸和碱的组成中都含有氢元素,右图是氢在元素周期表中的一些信息,下列说法中错误的是
C
C
.A.氢元素属于非金属元素 B.氢原子核内质子数为1
C.氢原子的质量为1.008 D.氢原子的结构示意图为
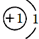
(2)盐酸和硫酸具有很多相似的化学性质,这是因为其溶液中都含有
H+
H+
(填符号).(3)小华同学打开盛放浓硫酸和浓盐酸的试剂瓶盖后,立即就能把它们区分开来,这是为什么?
(4)在进行酸碱中和反应的实验时,小明同学向烧杯中的氢氧化钠溶液滴加稀硫酸,一会儿发现由于忘记了滴加酚酞指示剂,因而无法确定稀硫酸与氢氧化钠是否恰好完全反应.
①同学们对溶质的成分提出了自己的看法:
小贝同学说:溶质除了硫酸钠还有氢氧化钠;小华同学说:溶质除了硫酸钠还有稀硫酸;小明同学说:溶质
只含硫酸钠
只含硫酸钠
多余的空
多余的空
.②为了证明大家的猜想,老师取出少量反应后的溶液于一支试管中,并向试管中滴加几滴酚酞溶液,振荡,观察到溶液无明显变化. 则这三位同学的猜想中不正确的是
小贝同学
小贝同学
.(5)小钢同学要配制70g溶质质量分数为5.4%的氯化铜溶液,经计算,他需要称量氯化铜的质量为
3.78
3.78
g.氯化铜溶液是蓝色的溶液,氯化铜溶液中主要含有Cu2+、Clˉ和水分子.某探究小组为探究氯化铜溶液中的哪种微粒能使氯化铜溶液显蓝色,设计了如下实验方案,得出了初步结论.请填写下表中的实验结论:
| 实 验 操 作 | 实验现象 | 实 验 结 论 |
| 取少量氯化钠固体,放入 试管中,加水,振荡 |
固体溶解, 溶液呈无色 |
氯化铜溶液中的Cu2+能使溶液显蓝色(或Clˉ和水分子不能使氯化铜溶液显蓝); 氯化铜溶液中的Cu2+能使溶液显蓝色(或Clˉ和水分子不能使氯化铜溶液显蓝); |
 大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:
大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3
| ||
| 反应时间/min | 0 | 5 | 9 | 12 | 15 |
| 剩余固体质量/g | 100 | 91.2 | 73.6 | 64.8 | 64.8 |
35.2
35.2
g.(2)100g大理石样品中杂质的质量是多少克?(写出计算过程)
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
(3)实验小组根据【实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.
该过程中的碳酸钙没有完全参加反应
该过程中的碳酸钙没有完全参加反应
.酸雨是pH小于5.6的降水.我国大部分地区所降酸雨主要是由居民和工厂燃烧含硫的煤以及某些化工厂生产过程中排放的二氧化硫气体,经过一系列化学反应而形成的.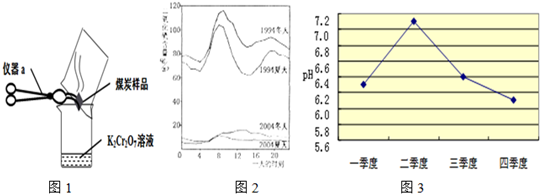
(1)如果硫粉在氧气中燃烧,观察到的现象是
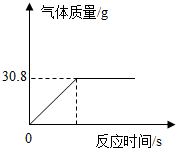
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称: +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
由此可知该雨水的酸性越来越
(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
查看习题详情和答案>>

(1)如果硫粉在氧气中燃烧,观察到的现象是
剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体
剧烈燃烧,放出热量,产生明亮的蓝紫色火焰,产生一种无色有刺激性气味的气体
,该反应的化学方程式为S+O2
SO2
| ||
S+O2
SO2
.
| ||
(2)几位同学为了探究木炭中是否含有少量硫元素,他们设计了如图1所示实验进行测定.请写出图中仪器a的名称:
坩埚钳
坩埚钳
.他们查阅资料后得知:“二氧化硫能使K2Cr2O7溶液褪色(由橙红色变成绿色),反应方程式为:“3SO2+K2Cr2O7+H2SO4═K2SO4+ +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:Cr2(SO4)3
Cr2(SO4)3
.反应前K2Cr2O7中Cr元素化合价为+6
+6
价.(3)如图2是1994年和2004年某城市的一天各个时刻测到的空气中二氧化硫的含量.下列说法不正确的是
D
D
A.曲线显示冬天大气中的二氧化硫含量比夏天高
B.曲线显示了1994年一天中大约8点左右二氧化硫的含量较高
C.二氧化硫的含量在10年间降低的原因可能是加强了燃料的脱硫和控制了二氧化硫的排放
D.二氧化硫污染的主要来源是汽车排放的尾气,控制污染的方法是禁止使用汽车
(4)在研究酸雨危害的过程中,测定该地区雨水的pH的实验操作
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
用玻璃棒蘸取雨水,点在试纸上,与标准比色卡对照,读取数值
.某化学兴趣小组取刚降到地面的雨水,每隔一定时间用较精密的pH计测定其pH,数据如下:
| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
强
强
(填“强”或“弱”),最终趋于稳定.可能的原因是雨水中的H2SO3被氧气氧化为H2SO4,化学方程式为2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(5)酸雨造成的危害很多.某兴趣小组调查发现某市的石刻的表面有不同程度的腐蚀.且近20年的腐蚀速度大大超过以往,其中最主要原因之一就是酸雨.为了减缓石刻腐蚀,请你提一条建议:
使用清洁能源
使用清洁能源
.酸雨会使河流、湖泊酸化.如图3是某市去年某河流一年中不同时期河水的平均pH变化的折线图.则去年河水酸性最强的季度是第四
四
季度.该季度雨水酸性最强的原因可能是:(答两条)冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染
冬季取暖,需要燃烧大量化石燃料,加大了对河水的污染
;冬季降水量减少,河水中酸的浓度增大
冬季降水量减少,河水中酸的浓度增大
.酸雨还会使土壤酸化.为了中和酸性土壤,可以使用熟石灰粉末,若该酸雨的成分是硫酸,请写出该中和反应的化学方程式
H2SO4+Ca(OH)2=CaSO4+2H2O
H2SO4+Ca(OH)2=CaSO4+2H2O
.(6)某校化学兴趣小组在学完碱的化学性质后,想到用NaOH溶液吸收SO2,反应化学方程式如下:2NaOH+SO2═Na2SO3+H2O 用NaOH溶液吸收1000L已除去CO2的空气样品,溶液质量增重了0.64g.已知此时空气的密度约为1.3g/L,求:
①被吸收的SO2的质量
0.8
0.8
g.②发生反应的NaOH的质量.(相对原子质量:Na-23 S-32 O-16)
③空气中SO2的质量分数(计算结果精确到0.01%).
大型纪录片《水问》,向人们说明了水是生命之源,万物之基,是人类最宝贵的自然资源,唤起人们认识水、了解水、关心水、爱护水、节约水的意识.
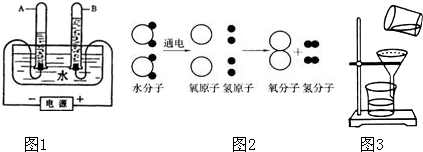
(1)认识水,了解水的组成.
①如图1是电解水的实验装置示意图,试管a中产生的气体是 ;发生反应的文字表达式是 .
②在某次电解水的实验中加入了少量的硫酸钠溶液,测得了分别与电源正负两极相连的阳、阴两极上产生的气体的实验数据如下:
仔细分析以上实验数据,1~4分钟内阴、阳两极生成的气体体积之比大于2:l,可能的原因是 .
③如图2是水分子分解的示意图,请从宏观、微观两个方面各写一条获得的化学信息.
Ⅰ. ;Ⅱ. ;
(2)关心水、爱护水,让水更好的为人类服务,我国规定水质必须在各种指标达标后方可以成为生活饮用水.各种指标的主要要求为:
a.不得呈现异色 b.不得有异味 c.应澄清透明 d.不得含有细菌和病毒
①为达到c指标,将静置后的河水采用如图3装置进行过滤,请问:图中还缺少的一种仪器是 ,若过滤后滤液仍然浑浊的可能原因是 (只要求说出一种原因).
②为了实现a、b指标,可以利用 (填物质名称)的吸附作用而达到;
③取适量经过上述①②步骤处理后得到的水于烧杯中,加入肥皂水并搅拌,发现烧杯中泡沫较少,但有大量浮渣,则说明河水是 (填“硬水”或“软水”),日常生活中使用硬水会带来许多麻烦,家庭生活中常用来降低水的硬度的方法是 .
④氮是农作物生长过程中重要的营养元素,合理的使用可以提高产量,如果施用不当是水体中含氮量超标的原因之一,可以污染水源.如图是某硝酸铵产品包装袋上的标签说明,请根据相关信息回答下列问题:
Ⅰ.NH4NO3的相对分子质量为 ;
Ⅱ.NH4NO3中氮、氢、氧三种元素的质量比为 ;
Ⅲ.通过计算说明该袋硝酸铵产品是混合物还是纯净物?
Ⅳ.一袋该产品中共含纯硝酸铵多少千克?(保留一位小数)
查看习题详情和答案>>

(1)认识水,了解水的组成.
①如图1是电解水的实验装置示意图,试管a中产生的气体是
②在某次电解水的实验中加入了少量的硫酸钠溶液,测得了分别与电源正负两极相连的阳、阴两极上产生的气体的实验数据如下:
| 时间/分钟 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
| 阳极生成气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 24 | 29 | 34 | 39 |
③如图2是水分子分解的示意图,请从宏观、微观两个方面各写一条获得的化学信息.
Ⅰ.
(2)关心水、爱护水,让水更好的为人类服务,我国规定水质必须在各种指标达标后方可以成为生活饮用水.各种指标的主要要求为:
a.不得呈现异色 b.不得有异味 c.应澄清透明 d.不得含有细菌和病毒
①为达到c指标,将静置后的河水采用如图3装置进行过滤,请问:图中还缺少的一种仪器是
②为了实现a、b指标,可以利用
③取适量经过上述①②步骤处理后得到的水于烧杯中,加入肥皂水并搅拌,发现烧杯中泡沫较少,但有大量浮渣,则说明河水是
④氮是农作物生长过程中重要的营养元素,合理的使用可以提高产量,如果施用不当是水体中含氮量超标的原因之一,可以污染水源.如图是某硝酸铵产品包装袋上的标签说明,请根据相关信息回答下列问题:
Ⅰ.NH4NO3的相对分子质量为
Ⅱ.NH4NO3中氮、氢、氧三种元素的质量比为
Ⅲ.通过计算说明该袋硝酸铵产品是混合物还是纯净物?
Ⅳ.一袋该产品中共含纯硝酸铵多少千克?(保留一位小数)
| 商品名:硝酸铵(NH4NO3) 净 重:50kg 含氮量:34% (氮元素都来自硝酸铵) ×××化工有限公司 |