题目内容
 大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:
大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3
| ||
| 反应时间/min | 0 | 5 | 9 | 12 | 15 |
| 剩余固体质量/g | 100 | 91.2 | 73.6 | 64.8 | 64.8 |
35.2
35.2
g.(2)100g大理石样品中杂质的质量是多少克?(写出计算过程)
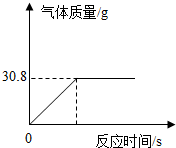
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
(3)实验小组根据【实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.
该过程中的碳酸钙没有完全参加反应
该过程中的碳酸钙没有完全参加反应
.分析:实验一:(1)根据质量守恒定律的有关应用分析解答即可;
(2)根据得到的二氧化碳的质量利用方程式对反应的碳酸钙质量进行计算,从而可得杂质的质量;
实验二:依据图象的信息可知生成的二氧化碳质量,结合实验一的计算结果进而可发现问题的错误所在;
(2)根据得到的二氧化碳的质量利用方程式对反应的碳酸钙质量进行计算,从而可得杂质的质量;
实验二:依据图象的信息可知生成的二氧化碳质量,结合实验一的计算结果进而可发现问题的错误所在;
解答:解:实验一:(1)根据质量守恒定律可知生成的二氧化碳质量是100g-64.8g=35.2g;
设参加反应的碳酸钙质量是x
(2)设大理石样品中含CaCO3的质量为x
CaCO3
CaO+CO2↑
100 44
x 35.2g
=
x=80g
故杂质的质量是100g-80g=20g
实验二:(3)由图象可知该反应最终生成的二氧化碳质量是30.8g;由于该样品最终生成的二氧化碳质量由(1)可知应该是35.2g,所以可判断该样品中的碳酸钙没有完全反应,故才会出现杂质的质量为30g;
故答案为:(1)35.2;(2)100g大理石样品中杂质的质量是20g;(3)该过程中的碳酸钙没有完全参加反应;
设参加反应的碳酸钙质量是x
(2)设大理石样品中含CaCO3的质量为x
CaCO3
| ||
100 44
x 35.2g
| 100 |
| x |
| 44 |
| 35.2g |
x=80g
故杂质的质量是100g-80g=20g
实验二:(3)由图象可知该反应最终生成的二氧化碳质量是30.8g;由于该样品最终生成的二氧化碳质量由(1)可知应该是35.2g,所以可判断该样品中的碳酸钙没有完全反应,故才会出现杂质的质量为30g;
故答案为:(1)35.2;(2)100g大理石样品中杂质的质量是20g;(3)该过程中的碳酸钙没有完全参加反应;
点评:分析反应前后物质质量变化的原因,根据质量守恒定律找出所记录实验数据中隐含的条件,是解决此类问题的一般方法.

练习册系列答案
相关题目
(1)根据方框内左侧的描述,找出右侧对应的化学符号,用线将它们连接起来.
| ①我是重要的建筑材料,石灰石、大理石中都有我 | a.Al | |
| ②我不能燃烧,可燃烧离不开我 | b.CaCO3 | |
| ③我是地壳中含量最高的金属元素,合金可用于制造飞机、火箭、轮船等 | c.O2 |
①原子结构示意图
 表示________(填写元素符号);
表示________(填写元素符号);②若“
 ”表示一个氮原子,则“
”表示一个氮原子,则“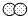 ”表示________(填写物质化学式);
”表示________(填写物质化学式);③符号“SO42-”表示________ (填写粒子名称)
 大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:
大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:
【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3 CaO+CO2↑,杂质不反应):
CaO+CO2↑,杂质不反应):
| 反应时间/min | 0 | 5 | 9 | 12 | 15 |
| 剩余固体质量/g | 100 | 91.2 | 73.6 | 64.8 | 64.8 |
(2)100g大理石样品中杂质的质量是多少克?(写出计算过程)
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
(3)实验小组根据【实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.______.
大理石是重要的建筑材料.为了测定某大理石样品中杂质的含量,某实验小组准确称取100g样品,设计了如下实验方案:
【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3 CaO+CO2↑,杂质不反应):
CaO+CO2↑,杂质不反应):
(1)100g大理石样品完全分解生成气体的质量是______g.
(2)100g大理石样品中杂质的质量是多少克?(写出计算过程)
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
(3)实验小组根据【实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.______.

【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3
 CaO+CO2↑,杂质不反应):
CaO+CO2↑,杂质不反应):| 反应时间/min | 5 | 9 | 12 | 15 | |
| 剩余固体质量/g | 100 | 91.2 | 73.6 | 64.8 | 64.8 |
(2)100g大理石样品中杂质的质量是多少克?(写出计算过程)
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
(3)实验小组根据【实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.______.

 表示
表示 ”表示一个氮原子,则“
”表示一个氮原子,则“ ”表示
”表示