摘要:26.化合物A由周期表中不同的短周期元素X.Y组成.是良好的耐热冲击材料. (1)X的单质既可与盐酸反应.又可与NaOH溶液反应.X的原子结构示意图为 . (2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 . (3)一定条件下.A和水缓慢作用生成含Y的化合物Z.Z分子含有10个电子. ①Z与H2O2反应.其产物之一是Y的单质.Y的单质的电子式为 ,Z分子的结构呈 . ②A的化学式是 . (4)X的单质.石墨和二氧化钛(TiO2)按比例混合.高温下反应得到的化合物均由两种元素组成.且都是新型陶瓷材料(在火箭和导弹上有重要应用).其反应的化学方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_1233000[举报]
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13.B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素.试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:
 .F的原子结构示意图为
.F的原子结构示意图为
 .
.
(2)B、D形成的化合物BD2中存在的化学键为
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为
(4)A、C、D、E的原子半径由大到小的顺序是
(5)元素B和F的非金属性强弱,B的非金属性
查看习题详情和答案>>
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:




(2)B、D形成的化合物BD2中存在的化学键为
共价
共价
键(填“离子”或“共价”,下同).A、C、F三种元素形成的化合物CA4F为离子
离子
化合物.(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性.则甲、乙反应的离子方程式为
OH-+HCO3-═CO32-+H2O
OH-+HCO3-═CO32-+H2O
.(4)A、C、D、E的原子半径由大到小的顺序是
Na>N>O>H
Na>N>O>H
(用元素符号表示).(5)元素B和F的非金属性强弱,B的非金属性
弱
弱
于F(填“强”或“弱”),并用化学方程式证明上述结论Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
Na2CO3+2HClO4═CO2↑+H2O+2NaClO4
.化合物X由元素A、B组成,可用于制造高性能的现代通讯材料-光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料.
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液.X与纯碱高温熔融能发生反应的原因是
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应.一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体.则Y的化学式是
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是(不必配平)
查看习题详情和答案>>
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是
第3周期、ⅣA
第3周期、ⅣA
.A可由X与焦炭在高温下反应制得,其反应的化学方程式为SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
.
| ||
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液.X与纯碱高温熔融能发生反应的原因是
难挥发性酸酐制取挥发性酸酐
难挥发性酸酐制取挥发性酸酐
;M与Z的水溶液能发生反应的原因是强酸制弱酸
强酸制弱酸
.要将纯碱高温熔化,下列坩埚中不可选用的是ABC
ABC
.A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应.一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体.则Y的化学式是
AlN
AlN
.(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是(不必配平)
4Al+3TiO2+3C
2Al2O3+3TiC
| ||
4Al+3TiO2+3C
2Al2O3+3TiC
.
| ||
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.(1)由A、C、D三元素所形成常见盐A4C2D3的溶液呈
酸
酸
性(填“酸”、“中”、“碱”),其原因用离子方程式表示为:NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
. NH3?H2O+H+
NH3?H2O+H+(2)B的相对分子质量最小的氢化物的燃烧热为890.3kJ?mol-1,写出其燃烧的化学方程式
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol
.(3)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下在2L的密闭容器中X、Y相互转化时的量变关系如图:
①该反应的化学方程式为
N2O4 2NO2
2NO2
 2NO2
2NO2N2O4 2NO2
2NO2
 2NO2
2NO2②反应进行到25min时,改变的条件可能是
D
D
A、缩小容器体积 B、充入0.4molNO2
C、充入0.4molN2O4 D、充入0.8molNO2
③30min后反应再次达到平衡,此时,Y转化为X的化学平衡常数为
0.9
0.9
(填数值).④若反应温度不变,在2L的密闭容器中充入1.4molY,反应达平衡后Y的转化率是
| 1 |
| 3 |
| 1 |
| 3 |
短周期元素a、b、c、d、e、f、g、h的原子序数依次增大.其中a是原子半径最小的原子,a和e、c和g、d和h同主族.b元素的最高正价和最低负价的绝对值之差为2; e单质能与冷水剧烈反应生成H2;f原子最外层电子数等于其周期序数;h-的电子层结构与Ar原子相同.
(1)f原子结构示意图为 ;d和e形成的化合物电子式为 ;
(2)c和f简单离子的半径大小为 ;(用离子符号和“>”“=”或“<”表示)
(3)c与g的气态氢化物沸点较高的是 (填氢化物 分子式),原因是 .
(4)元素非金属性强弱的比较有很多方法,其中g和h的非金属性强弱的研究方案中不可行的是 (填序号);
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较两种单质常温下的状态 ④比较最高价氧化物对应水化物的酸性
⑤由g和h的相互制备情况进行判断
(5)写出e、f的最高价氧化物对应水化物间反应的离子方程式 .
查看习题详情和答案>>
(1)f原子结构示意图为
(2)c和f简单离子的半径大小为
(3)c与g的气态氢化物沸点较高的是
(4)元素非金属性强弱的比较有很多方法,其中g和h的非金属性强弱的研究方案中不可行的是
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较两种单质常温下的状态 ④比较最高价氧化物对应水化物的酸性
⑤由g和h的相互制备情况进行判断
(5)写出e、f的最高价氧化物对应水化物间反应的离子方程式
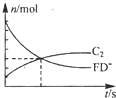 短周期元素A-F的原子序数依次增大,部分元素的信息如下:
短周期元素A-F的原子序数依次增大,部分元素的信息如下:| 元素编号 | 信息 |
| B | 与元素A、D共同组成的化合物的种类最多 |
| D | 最外层电子数是次外层电子数的三倍 |
| E | 同周期元素中形成的简单离子半径最小 |
| F | 最高价氧化物对应的水化物的酸性最强 |
(1)某容器中发生一个化学反应,反应过程中存在A2D、FD-、BC-,ABD3-、C2、F-等六种粒子,测得FD-和C2的物质的量随时间变 化的曲线如图所示.请写出该反应的离子方程式
(2)W与D是相邻的同主族元素.在下表中列出H2WO3的不同化学性质,举例并写出 相应的化学方程式
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3=3H3PO4+H2W↑ |
| ① | ||
| ② |
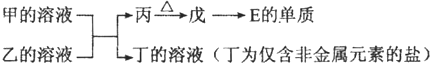
①写出甲的溶液与乙的溶液反应的离子方程式
②鉴定丁中阳离子的操作是
③如果丁中含有元素F,丁的溶液中离子浓度由大到小的排列顺序是