题目内容
 短周期元素A-F的原子序数依次增大,部分元素的信息如下:
短周期元素A-F的原子序数依次增大,部分元素的信息如下:| 元素编号 | 信息 |
| B | 与元素A、D共同组成的化合物的种类最多 |
| D | 最外层电子数是次外层电子数的三倍 |
| E | 同周期元素中形成的简单离子半径最小 |
| F | 最高价氧化物对应的水化物的酸性最强 |
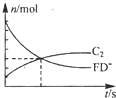
(1)某容器中发生一个化学反应,反应过程中存在A2D、FD-、BC-,ABD3-、C2、F-等六种粒子,测得FD-和C2的物质的量随时间变 化的曲线如图所示.请写出该反应的离子方程式
(2)W与D是相邻的同主族元素.在下表中列出H2WO3的不同化学性质,举例并写出 相应的化学方程式
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3=3H3PO4+H2W↑ |
| ① | ||
| ② |
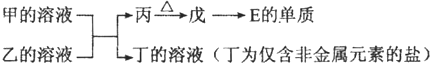
①写出甲的溶液与乙的溶液反应的离子方程式
②鉴定丁中阳离子的操作是
③如果丁中含有元素F,丁的溶液中离子浓度由大到小的排列顺序是
分析:短周期元素A-F的原子序数依次增大,D最外层电子数是次外层电子数的三倍,D原子只能有2个电子层,最外层电子数为6,则D为氧元素;B与元素A、D共同组成的化合物的种类最多,应是有机物,故A为氢元素、B为碳元素;结合原子序数可知C为氮元素;E是同周期元素中形成的简单离子半径最小,则E只能处于第三周期,故E为Al;F最高价氧化物对应的水化物的酸性最强,则F为Cl,
(1)某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-,HCO3-、N2、Cl-等六种粒子,由图可知,随反应进行,ClO-物质的量减小,N2的物质的量增大,说明ClO-是反应物,N2是产物,根据电子转移守恒可知,CN-是反应物、Cl-是产物,结合元素守恒可知,HCO3-是生成物,H2O是反应物,配平书写离子方程式;
(2)W与D是相邻的同主族元素,则W为S元素,H2SO3的具有氧化性、还原性、酸性、不稳定性等,据此写出相应的化学方程式;
(6)丁是仅含非金属的盐,所以一定是铵盐,E为Al元素,所以推断戊是氧化铝,故丙是氢氧化铝,分析产物结合反应:甲+乙+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,③中如果丁中含有元素F(Cl元素),则丁为氯化铵,溶液中NH4+离子水解,破坏水的电离平衡,水溶液显酸性,据此判断离子浓度.
(1)某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-,HCO3-、N2、Cl-等六种粒子,由图可知,随反应进行,ClO-物质的量减小,N2的物质的量增大,说明ClO-是反应物,N2是产物,根据电子转移守恒可知,CN-是反应物、Cl-是产物,结合元素守恒可知,HCO3-是生成物,H2O是反应物,配平书写离子方程式;
(2)W与D是相邻的同主族元素,则W为S元素,H2SO3的具有氧化性、还原性、酸性、不稳定性等,据此写出相应的化学方程式;
(6)丁是仅含非金属的盐,所以一定是铵盐,E为Al元素,所以推断戊是氧化铝,故丙是氢氧化铝,分析产物结合反应:甲+乙+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,③中如果丁中含有元素F(Cl元素),则丁为氯化铵,溶液中NH4+离子水解,破坏水的电离平衡,水溶液显酸性,据此判断离子浓度.
解答:解:短周期元素A-F的原子序数依次增大,D最外层电子数是次外层电子数的三倍,D原子只能有2个电子层,最外层电子数为6,则D为氧元素;B与元素A、D共同组成的化合物的种类最多,应是有机物,故A为氢元素、B为碳元素;结合原子序数可知C为氮元素;E是同周期元素中形成的简单离子半径最小,则E只能处于第三周期,故E为Al;F最高价氧化物对应的水化物的酸性最强,则F为Cl,
(1)反应过程中存在H2O、ClO-、CN-,HCO3-、N2、Cl-等六种粒子,由图可知,随反应进行,ClO-物质的量减小,N2的物质的量增大,说明ClO-是反应物,N2是产物,根据电子转移守恒可知,CN-是反应物、Cl-是产物,结合元素守恒可知,HCO3-是生成物,H2O是反应物,反应离子方程式为:5ClO-+2CN-+H2O=2HCO3-+N2↑+5Cl-,
故答案为:5ClO-+2CN-+H2O=2HCO3-+N2↑+5Cl-;
(2)W与D(氧元素)是相邻的同主族元素,则W为S元素,H2SO3的具有氧化性、还原性、酸性、不稳定性等,可以被强氧化剂氧化,如H2SO3+Br2+2H2O=H2SO3+2HBr,与NaOH发生中和反应H2SO3+2NaOH=Na2SO3+2H2O,
故答案为:
(6)丁是仅含非金属的盐,所以一定是铵盐,E为Al元素,所以推断戊是氧化铝,故丙是氢氧化铝,分析产物结合反应:甲+乙+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,③中如果丁中含有元素F(Cl元素),
①甲的溶液与乙的溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
②丁中阳离子为NH4+,鉴定NH4+的操作是:取少量丁样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:取少量丁样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
③如果丁中含有元素F(Cl元素),则丁为氯化铵,溶液中NH4+离子水解,破坏水的电离平衡,水溶液显酸性,且水解程度不大,故溶液中离子浓度c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(1)反应过程中存在H2O、ClO-、CN-,HCO3-、N2、Cl-等六种粒子,由图可知,随反应进行,ClO-物质的量减小,N2的物质的量增大,说明ClO-是反应物,N2是产物,根据电子转移守恒可知,CN-是反应物、Cl-是产物,结合元素守恒可知,HCO3-是生成物,H2O是反应物,反应离子方程式为:5ClO-+2CN-+H2O=2HCO3-+N2↑+5Cl-,
故答案为:5ClO-+2CN-+H2O=2HCO3-+N2↑+5Cl-;
(2)W与D(氧元素)是相邻的同主族元素,则W为S元素,H2SO3的具有氧化性、还原性、酸性、不稳定性等,可以被强氧化剂氧化,如H2SO3+Br2+2H2O=H2SO3+2HBr,与NaOH发生中和反应H2SO3+2NaOH=Na2SO3+2H2O,
故答案为:
| 编号 | 性质 | 化学方程式 |
| 示例 | H2WO3+3H3PO3═3H3PO4+H2W↑ | |
| 1 | 还原性 | H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH=Na2SO3+2H2O |
①甲的溶液与乙的溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;
②丁中阳离子为NH4+,鉴定NH4+的操作是:取少量丁样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子,
故答案为:取少量丁样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
③如果丁中含有元素F(Cl元素),则丁为氯化铵,溶液中NH4+离子水解,破坏水的电离平衡,水溶液显酸性,且水解程度不大,故溶液中离子浓度c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评:本题考查无机物的推断、结构性质位置关系应用、常用化学用语、盐类水解、元素化合物性质、实验方案设计等,元素及物质的推断是解答本题的关键,注重对高考常考考点的考查,对学生能力要求较高,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的 2MgO+C
2MgO+C