摘要:25.773K时.固定体积的容器中.反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如下图. (1)该反应的热化学方程式为: . (2)该反应的平衡常数表达式为K= .若升高温度K (填“变大 .“变小 或“不变 ). (3)下列关于曲线Ⅱ的说法中.正确的是 . a.曲线Ⅱ的变化是因为降低了温度.反应速率变慢 b.曲线Ⅱ的变化是使用了催化剂.反应速率加快了 c.曲线Ⅱ的反应的转化率比反应Ⅰ的高 d.曲线Ⅱ的反应的放出的热量比反应Ⅰ的少 (4)若投入a mol CO.2a mol H2.平衡时能生成0.1a mol CH3OH.反应就具有工业应用价值. ① 若按上述投料比使该反应具有工业应用价值.CO的平衡转化率最小为 , ② 在容器容积不变的前提下.欲提高H2的转化率.可采取的措施 . (5)用下图装置电解苦卤水(含Cl-.Br-.Na+.Mg2+)的装置如图所示.下列说法中.正确的是 A.甲池负极反应式为:CH3OH + H2O → CO2 +6H+ + 6e- B.乙池a 电极周围首先放电的是Br-而不是Cl-.说明当其它条 件相同时前者的还原性强于后者 C.电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 D.忽略能量损耗.当电池中消耗0.5molO2 时.b 极周围会产生2g H2
网址:http://m.1010jiajiao.com/timu3_id_1232335[举报]
(2010?杭州一模)对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应原理的系列研究,请根据相关信息回答有关问题.
(1)关于反应生成物的定量研究:
已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,反应后,溶液中除含有Cl-外,还一定
A.含Fe2+,不含Fe3+B.含Fe3+,不含Br-C.含Fe3+,含有Br-
(2)关于反应限度的研究:
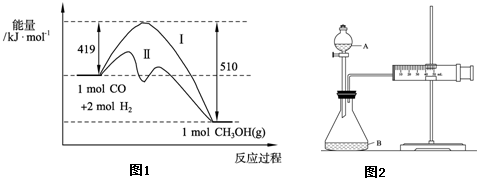
已知在773K、固定体积的容器中,反应CO(g)+2H2(g)?CH3OH(g)过程中能量变化如图1.曲线Ⅱ表示使用催化剂时的能量
变化.若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可):
(3)关于反应速率的研究:
氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO3发生 的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
①KMnO4、Na2CO3、CuO、KI四种物质中的
②欲用图2装置测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定
查看习题详情和答案>>

(1)关于反应生成物的定量研究:
已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,反应后,溶液中除含有Cl-外,还一定
C
C
.(填字母序号)A.含Fe2+,不含Fe3+B.含Fe3+,不含Br-C.含Fe3+,含有Br-
(2)关于反应限度的研究:
已知在773K、固定体积的容器中,反应CO(g)+2H2(g)?CH3OH(g)过程中能量变化如图1.曲线Ⅱ表示使用催化剂时的能量
变化.若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为
10%
10%
;②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可):
增大CO浓度
增大CO浓度
、适当降低温度或及时分离CH3OH
适当降低温度或及时分离CH3OH
;(3)关于反应速率的研究:
氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO3发生 的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
①KMnO4、Na2CO3、CuO、KI四种物质中的
KI
KI
(填化学式)能使上述还原过程发生.②欲用图2装置测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定
单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
推(计)算反应速率. CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。 
 CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1 