题目内容
(2010?杭州一模)对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应原理的系列研究,请根据相关信息回答有关问题.
(1)关于反应生成物的定量研究:
已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,反应后,溶液中除含有Cl-外,还一定
A.含Fe2+,不含Fe3+B.含Fe3+,不含Br-C.含Fe3+,含有Br-
(2)关于反应限度的研究:
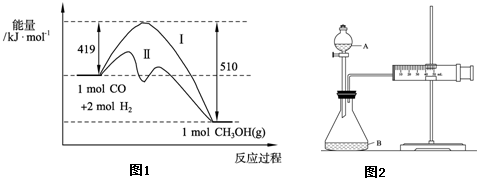
已知在773K、固定体积的容器中,反应CO(g)+2H2(g)?CH3OH(g)过程中能量变化如图1.曲线Ⅱ表示使用催化剂时的能量
变化.若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可):
(3)关于反应速率的研究:
氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO3发生 的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
①KMnO4、Na2CO3、CuO、KI四种物质中的
②欲用图2装置测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定

(1)关于反应生成物的定量研究:
已知反应:Br2+2Fe2+═2Br-+2Fe3+,向10mL 0.1mol?L-1的FeBr2溶液中通入0.001mol Cl2,反应后,溶液中除含有Cl-外,还一定
C
C
.(填字母序号)A.含Fe2+,不含Fe3+B.含Fe3+,不含Br-C.含Fe3+,含有Br-
(2)关于反应限度的研究:
已知在773K、固定体积的容器中,反应CO(g)+2H2(g)?CH3OH(g)过程中能量变化如图1.曲线Ⅱ表示使用催化剂时的能量
变化.若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值.
①若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为
10%
10%
;②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可):
增大CO浓度
增大CO浓度
、适当降低温度或及时分离CH3OH
适当降低温度或及时分离CH3OH
;(3)关于反应速率的研究:
氧化还原反应中实际上包含氧化和还原两个过程.下面是HNO3发生 的一个还原过程的反应式:NO3-+4H++3e-→NO+2H2O
①KMnO4、Na2CO3、CuO、KI四种物质中的
KI
KI
(填化学式)能使上述还原过程发生.②欲用图2装置测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定
单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
推(计)算反应速率.分析:(1)向溴化亚铁溶液中通入氯气,氯气先和亚铁离子反应生成铁离子,然后氯气再和溴离子反应生成溴单质,根据离子反应先后顺序及物质的量之间的关系确定产物;
(2)①转化率=参加反应的CO的物质的量与最初CO的物质的量之比;
②要提高H2的转化率,可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法;
(3)①根据物质中的元素的化合价处于低价时具有还原性,据此判断;
②根据v=
判断.
(2)①转化率=参加反应的CO的物质的量与最初CO的物质的量之比;
②要提高H2的转化率,可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法;
(3)①根据物质中的元素的化合价处于低价时具有还原性,据此判断;
②根据v=
| △V |
| △t |
解答:解:(1)n(FeBr2)=0.1molo/L×0.01L=0.001mol,当n( Fe2+):n(Cl2)≥2时,发生的反应为:2 Fe2++Cl2=Fe3++2Cl-;当n( Fe2+):n(Cl2)≤
时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,根据题意知,实际上n( Fe2+):n(Cl2)=1,介于二者之间,所以原溶液中亚铁离子完全反应,部分溴离子参加反应,所以溶液中的溶质是溴化铁和氯化铁,故溶液中一定还存在铁离子、溴离子,故选C;
(2)①若不采取其它方法改变平衡移动时,CO的转化率最小,根据方程式知,参加反应的一氧化碳和生成的甲醇的物质的量相等,所以CO的平衡转化率最小为=
×100%=10%,故答案为:10%;
②可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法来促使平衡向正反应方向移动,从而提高氢气的转化率,故答案为:增大CO浓度、适当降低温度、及时分离生成的CH3OH;
(3)①KMnO4、Na2CO3、CuO、KI四种物质中Mn、C、Cu三种元素都处于最高价态,只有KI中碘元素处于最低价态,则具有还原性,故答案为:KI;
②根据v=
知,可以通过测定单位时间内收集的气体体积(或收集一定体积的气体所用的时间) 推(计)算反应速率,
故答案为:单位时间内收集的气体体积(或收集一定体积的气体所用的时间).
| 2 |
| 3 |
(2)①若不采取其它方法改变平衡移动时,CO的转化率最小,根据方程式知,参加反应的一氧化碳和生成的甲醇的物质的量相等,所以CO的平衡转化率最小为=
| 0.1amol |
| amol |
②可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法来促使平衡向正反应方向移动,从而提高氢气的转化率,故答案为:增大CO浓度、适当降低温度、及时分离生成的CH3OH;
(3)①KMnO4、Na2CO3、CuO、KI四种物质中Mn、C、Cu三种元素都处于最高价态,只有KI中碘元素处于最低价态,则具有还原性,故答案为:KI;
②根据v=
| △V |
| △t |
故答案为:单位时间内收集的气体体积(或收集一定体积的气体所用的时间).
点评:本题考查氧化还原反应的有关计算、化学平衡的移动等知识点,易错题是(1)题,注意溴离子和亚铁离子与氯气反应的先后顺序,如果是碘离子和亚铁离子与氯气反应,其先后顺序又该如何.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目