摘要:中和一定质量的稀H2SO4可用a g m%的NaOH溶液.若现在改用a g m%的KOH溶液来中和.完全反应后.所得溶液的pH为------------------------------------- A 大于7 B 小于7 C 等于7 D 无法确定
网址:http://m.1010jiajiao.com/timu3_id_103937[举报]
中和一定质量的稀H2SO4可用a g m%的NaOH溶液,若现在改用a g m%的KOH溶液来中和,完全反应后,所得溶液的pH为-------------------------------------( )
A 大于7 B 小于7 C 等于7 D 无法确定
查看习题详情和答案>>
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
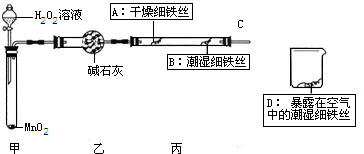
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是 .
(2)反应开始后,甲装置中反应现象是 ,MnO2的作用 .
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与 和 有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是 .
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3?H2O 178,FeCO3116)
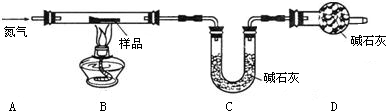
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为 g,D装置中碱石灰的作用是 .
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为 、 .
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═ g.
②锈铁钉中FeCO3的质量═ g.
③锈铁钉中单质铁的质量分数═ .
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2? (填“有”或“无”),请通过计算说明.(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程]. 查看习题详情和答案>>
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.

(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是
(2)反应开始后,甲装置中反应现象是
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3?H2O 178,FeCO3116)

(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═
②锈铁钉中FeCO3的质量═
③锈铁钉中单质铁的质量分数═
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程]. 查看习题详情和答案>>
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
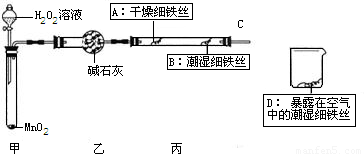
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______.
(2)反应开始后,甲装置中反应现象是______,MnO2的作用______.
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______.
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.
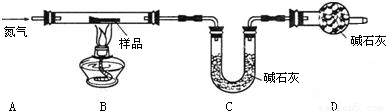
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为______g,D装置中碱石灰的作用是______.
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______.
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═______g.
②锈铁钉中FeCO3的质量═______g.
③锈铁钉中单质铁的质量分数═______.
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?______(填“有”或“无”),请通过计算说明.(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程].
查看习题详情和答案>>
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.

(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______.
(2)反应开始后,甲装置中反应现象是______,MnO2的作用______.
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______.
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.

(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为______g,D装置中碱石灰的作用是______.
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______.
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═______g.
②锈铁钉中FeCO3的质量═______g.
③锈铁钉中单质铁的质量分数═______.
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?______(填“有”或“无”),请通过计算说明.(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程].
查看习题详情和答案>>
(2007?扬州)全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
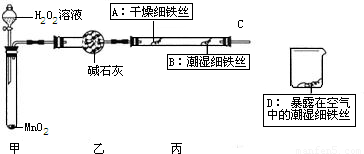
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______.
(2)反应开始后,甲装置中反应现象是______,MnO2的作用______.
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______.
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3?H2O 178,FeCO3116)
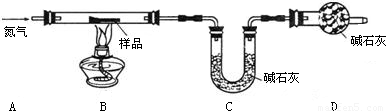
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为______g,D装置中碱石灰的作用是______.
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______.
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═______g.
②锈铁钉中FeCO3的质量═______g.
③锈铁钉中单质铁的质量分数═______.
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?______(填“有”或“无”),请通过计算说明.(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程].
查看习题详情和答案>>
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.

(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______.
(2)反应开始后,甲装置中反应现象是______,MnO2的作用______.
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______.
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3?H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe2O3?H2O加热Fe2O3+H2O,FeCO3加热FeO+CO2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3?H2O 178,FeCO3116)

(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水 蒸气的总质量为______g,D装置中碱石灰的作用是______.
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______.
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3?H2O的质量═______g.
②锈铁钉中FeCO3的质量═______g.
③锈铁钉中单质铁的质量分数═______.
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?______(填“有”或“无”),请通过计算说明.(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:
Fe+Fe2(SO4)3═3FeSO4,Fe2(SO4)3的相对分子质量为400)
[计算过程].
查看习题详情和答案>>
如图1所示为实验室常用的实验装置.
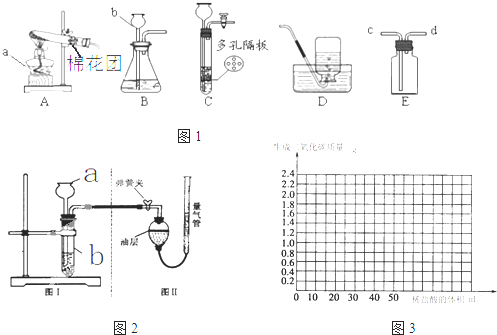
(1)写出下列仪器名称:a
(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是
(4)装置C相对于装置B在操作方面的优势为
A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
[拓展实验二]测定石头纸中碳酸钙的质量分数
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性
②图2(Ⅱ)装置中油层的作用是
③反应停止后,
A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
通过对数据的分析和比较,回答下列有关问题:
①在第1份样品的实验中,
②m为
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.
 .
.
查看习题详情和答案>>

(1)写出下列仪器名称:a
酒精灯
酒精灯
;b长颈漏斗
长颈漏斗
.(2)实验室用高锰酸钾制取氧气时,应选择的发生装置是
A
A
(填装置的字母代号),化学方程式是2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,用双氧水制取氧气的化学方程式为
| ||
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(3)实验室用锌和稀硫酸反应制取氢气的化学方程式是
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
,若将E装置中收集的氢气排出,应从c
c
(填c或d)口通入蒸馏水.(4)装置C相对于装置B在操作方面的优势为
C
C
.A.可以随时加液 B.可以控制反应速率 C.可以控制反应发生与停止
同学们对美术组的环保石头纸(主要成分为碳酸钙,加入适量聚乙烯和少量胶合剂)展开探究:
[拓展实验一]探究影响石头纸与盐酸反应快慢的因素
(5)甲、乙两同学设计实验如下:
| 甲 | 乙 | |
| 实验过程 | 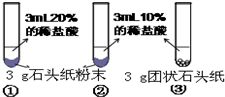 |
 |
| 现象 | 试管①、②、③中产生气泡快慢的顺序为: ①>②>③. |
|
| 分析结论 | Ⅰ碳酸钙与稀盐酸反应的化学方程式为 CaCO3+2HCl═2CaCl2+H2O+CO2↑ CaCO3+2HCl═2CaCl2+H2O+CO2↑ Ⅱ对比甲同学实验①②可知, 盐酸越浓(溶质的质量分数越大) 盐酸越浓(溶质的质量分数越大) ,化学反应的速度越快;Ⅲ对比甲同学实验 ②③ ②③ (填实验序号)可知,反应物的接触面积越大,反应速率越快 快 .Ⅳ乙同学的实验中,数据记录纸上应该连续记录的实验数据是 时间 时间 和锥形瓶及药品的质量或二氧化碳的质量 锥形瓶及药品的质量或二氧化碳的质量 . | |
(6)甲组同学的方法是:(同温同压下,不同气体混合后体积等于混合前各气体体积之和.)
将样品与稀盐酸反应,测定反应后生成CO2的体积,再换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.图2(Ⅰ)为石头纸与稀盐酸反应的装置,图2(Ⅱ)用于测量CO2的体积.
①连接仪器,夹紧弹簧夹,向a中加入一定量的水,如果a、b中有稳定的高度差,说明:装置2(I)气密性
良好
良好
(选填“良好”或“漏气”)②图2(Ⅱ)装置中油层的作用是
防止二氧化碳溶于水、与水反应或隔绝二氧化碳与水
防止二氧化碳溶于水、与水反应或隔绝二氧化碳与水
;③反应停止后,
B
B
(填序号)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.A.水平移动量气管 B.上下移动量气管 C.封闭量气管
(7)乙组同学的实验方法是:均匀称取四份样品分别和稀盐酸反应,用电子天平及有关装置,得出二氧化碳质量,实验数据记录如表.(其他物质既不溶于水也不跟酸反应)
| 第一份 | 第二份 | 第三份 | 第四份 | |
| 取样品质量(g) | 6.25 | 6.25 | 6.25 | 6.25 |
| 取稀盐酸的体积(mL) | 10.0 | 20.0 | 30.0 | 40.0 |
| 产生气体的质量(g) | 0.88 | 1.76 | 2.20 | m |
①在第1份样品的实验中,
盐酸
盐酸
完全反应了.②m为
2.20
2.20
③石头纸样品中碳酸钙的质量分数是多少?(请写出计算过程)
④请在坐标图3中画出在6.25g样品中加入稀盐酸的体积与产生气体质量的关系图.

