汕头市2009年高中毕业生学业水平考试
化 学
本试卷共12页,27小题,满分150分。考试用时120分钟。
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、座位号分别填写在答题卡上,用2B铅笔将答题卡试卷类型(A)填涂在答题卡上,并在答题卡右上角的“考试科目”栏将相应的科目信息点涂黑。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题纸上各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将试卷和答题卡一并交回。
可能用到的原子量:C 12 、H 1 、O 16 、S 32 、N 14 、Cl 35.5 、Br 80 、Na 23、
Mg 24 、Al 27 、Mn 55 、Fe 56 、Cu 64 、Ag 108
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意)
1.2008年初,南方经历了50年一遇的大雪灾,导致交通中断,电网大面积瘫痪。为了打通京珠高速,有关部门在京珠高速上撒下了数千吨融雪剂帮助破冰除雪,恢复交通。融雪剂主要分为两大类,一类是以醋酸钾为主要成分的有机融雪剂,虽然这一类融雪剂融雪效果好,没有什么腐蚀损害,但它的价格太高,一般只适用于机场等地。而另一类则是氯盐类融雪剂,包括氯化钠、氯化钙、氯化镁、氯化钾等,通称作“化冰盐”。它的优点是便宜,价格仅相当于有机类融雪剂的1/10,但它对大型公共基础设施的腐蚀是很严重的。下列说法中不正确的是
A.通过在熔融状态下能否导电来证明CaCl2是否为离子化合物
B.CaCl2通常用作干燥剂,但是不能干燥NH3
C.电化学腐蚀是造成钢铁腐蚀的主要原因
D.“化冰盐"可以替代食盐来作调味剂,氯盐类融雪剂不会造成地下水污染
2.2007年诺贝尔化学奖授予德国化学家格哈德?埃特尔是因为他在表面化学所作的研究。以下事实或现象与表面化学无密切关系的是
A.配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
B.用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
C.用明矾来净水
D.熔化的铝不易滴落下来
3.2007年10月,一台湾女孩因食用河虾后服用大剂量的维生素C而中毒。菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的3价砷。下列说法正确的是
A.在该反应中维生素C作催化剂
B.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷可能是3价砷
C.因为河虾中含有砷元素,所以不能食用
D.上述反应中维生素作氧化剂
4.对经常出现的客观现象进行归纳可以形成相应规律,但客观事物有时也会有违背普遍规律的现象,寻找例外现象出现的原因正是科学发展的内在动力。下列事实与相关规律不相吻合并有其内在原因的是
A.Cs是很活泼的金属 B.I2易溶于四氯化碳
C.HF在标准状况下是液体 D.Cl在第三周期中原子半径最小
5.下列有关工业生产的叙述不正确的是:
A.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO2转化为SO3时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阳极室产生的C12进入阴极室
D.电解精炼铜时,同一时间内阳极减少的质量比阴极增加的质量小
6.用NA表示阿伏加德罗常数值,下列说法正确的是
A.
B.
C.
D.
7.雷达的微波过滤器里使用铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是
A.可表示为3YO3?3FeO?Fe2O3 B.可表示为Y3O5?Fe3O4?Fe2O3
C.其中钇、铁的化合价均为+3价 D.其中钇、铁的化合价均有+2、+3价
8.Al(OH)3难溶于水,某温度下,只要溶液中Al3+物质的量浓度(mol/L)和OH-物质的量浓度(mol/L)3次方的乘积大于1.9×10-33,就会析出Al(OH)3沉淀,则0.10 mol/L AlCl3不产生沉淀的最大OH-物质的量浓度(mol/L)为
A.1.9×10-33 B.2.7×10-11 C.8.7×10-8 D.1.2× 10-11
9.质量分数为ω的NaOH溶液,其物质的量浓度为a mol?L-1,加热蒸发水份使其质量分数变为2ω,此时,该溶液中NaOH的物质的量浓度为b mol?L-1,则a与b的关系正确的是
A.b=
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个,该小题为0分)
10.对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.平衡时,v正(O2)=v逆(O2)必成立
B.关系式5v正(O2)=4v正(NO)总成立
C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最大
D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO
11.下列离子方程式中正确的是
A.NaHSO4溶液中加Ba(OH)2溶液至中性: Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
B.NH4HCO3溶液与过量NaOH溶液反应: NH4+ + OH‑ = NH3↑+H2O
C.AlCl3溶液中滴加浓氨水至过量: Al3++4NH3?H2O = AlO2―+4NH4++2H2O
D.向硫酸亚铁的酸性溶液中滴入双氧水: 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
12.下列各种情况下,常温下溶液中可能大量存在的离子组是
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、OH-、NO3-
B.加入铝粉能放出大量H2的溶液中:Na+、SO42-、Cl-、NH4+
C.pH=7的中性溶液中:Fe3+、Cl-、HCO3-、K+
D.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
13.一定条件下用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 ( g )+4NO2( g ) == 4NO( g )+CO2( g )+2H2O( g ) △H=-574 kJ?mol-1
② CH4 ( g )+4NO( g ) == 2N2( g )+CO2( g )+2H2O( g ) △H=-1 160 kJ?mol一1。
下列正确的选项是
A.CH4 ( g ) + 2NO2 ( g ) == N2( g )+CO2 ( g ) + 2H2O ( l ) △H=-867 kJ?mol-1
B.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2 mol
C.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
D.若用标准状况下
14.几种短周期元素的原子半径及主要化合价见下表:
元素代号
K
L
M
Q
R
T
N
原子半径/nm
0.183
0.160
0.143
0.102
0.089
0.074
0.152
主要化合价
+1
+2
+3
+6、-2
+2
-2
+1
下列叙述正确的是
A.K、L、M三元素的金属性逐渐增强
B.在RCl2分子中,各原子均满足8电子的稳定结构
C.Q元素的最高价氧化物为电解质,其水溶液能够导电
D.K在T单质中燃烧所形成的化合物中含有非极性共价键和离子键
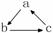 15.下列各组物质中,不是按
(“→”表示一步完成)关系相互转化的是
15.下列各组物质中,不是按
(“→”表示一步完成)关系相互转化的是
选项
A
B
C
D
a
Fe
SiO2
Al(OH)3
HNO3
b
FeCl3
Na2SiO3
NaAlO2
NO
c
FeCl2
H2SiO3
Al2O3
NO2
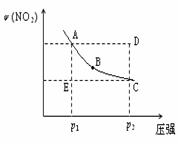 16.对于反应N2O4(g)
16.对于反应N2O4(g)  2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是
A.A、C两点的正反应速率的关系为 v(A)<v (C)
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C.维持p1不变,E→A所需时间为x;维持p2不变,D→C 所 需时间为y,则x<y
D.使E状态从水平方向到达C状态后,再沿平衡曲线到 达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1 。
17.已知
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(
1.8×l0_5
4.9×l0_10
K1=4.3×l0_7
K2=5.6×l0_11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +
C.a mol?L-1 HCN溶液与b mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
18.某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
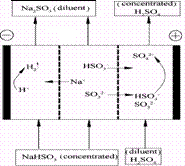 A.阳极区酸性增强
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e―=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
三、(本题包括3小题,共36分)
19.(14分)
粗盐提纯的研究。
【有关资料】
化学式
CaCO3
CaSO3
CaC2O4
Mg(OH)2
Ksp
4.96×10―9
4.96×10―9
2.34×10―9
5.61×10―12
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42―的存在),该小组设计流程如下:
 【设计除杂过程】
【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是_______ ________________
________________________________________________________________________。
(2)混合液A的主要成分是____________________。(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A、Na2CO3 B、Na2SO
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol?L―1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到
___________ _____________时(填现象),停止加热。
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 ,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在______________以下。
20.(8分)
间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+ 与 I―作用定量析出 I2;I2 溶于过量的KI溶液中:I2 + I- ==I3-;且在溶液中:Fe3+ +6F- = [FeF6]3- ( 六氟合铁(III)络离子 )
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32- + I3- == S4O62- + 3I-。
现准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是 ;
(2)实验中加入稀硫酸,你认为硫酸的作用是 ;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为 ;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为: ;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu) = 。
 21.(16分)
21.(16分)
甲酸(CH2O2),俗称蚁酸,结构式为: 。某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
 猜想I:甲酸具有酸性;
猜想I:甲酸具有酸性;
实验I:在甲酸溶液中滴加紫色石蕊试液;
猜想II:甲酸能发生银镜反应;
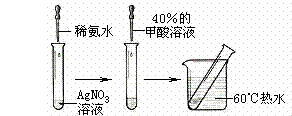
实验II:操作过程如右图所示;
回答下列问题:
⑴请你再设计出至少2个实验方案来验证甲酸的酸性: 、 ;
⑵请你进一步设计实验方案证明甲酸是弱酸 ;
⑶依右上图所示的实验,加热20分钟后并没有出现预期的实验现象。该小组同学预期的实验现象是 ,请你从理论上简单解释实验中没有出现该现象的原因 ;
⑷在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
①你提出的猜想是 ;
 ②你设计的实验方案是:
②你设计的实验方案是:
 实验方案请参考如下形式:
实验方案请参考如下形式:
22.(9分)
四、(本题包括3小题,共33分)
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3 SiO2(s)+ 6 C(s) + 2 N2(g)
Si3N4(s)+ 6 CO(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3 SiO2(s)+ 6 C(s) + 2 N2(g)
Si3N4(s)+ 6 CO(g)
(1)该反应的氧化剂是 ,其还原产物是 ;
(2)该反应的平衡常数表达式为 K= ;
(3)若知上述反应为放热反应,则其反应热△H 0(填“>”、“<”或“=”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol?L-1?min-1,则N2消耗速率为v(N2)= 。
 (4)达到平衡后,改变某一外界条件(不改变
(4)达到平衡后,改变某一外界条件(不改变
N2、CO的量),反应速率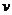 与时间t的关系如右图。
与时间t的关系如右图。
图中t4时引起平衡移动的条件可能是
;图中表示平衡混合
物中CO的含量最高的一段时间是 。
(5)若该反应的平衡常数为K=729,则在同温度下
23. (11分)
某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___ ________。(填序号)
A.铝与Cl―反应,铝与SO42―不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是 。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_ _ __。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
选项
铝电极
电解质
负极反应
正极反应
A
负极
NaOH
2Al―6e―+8OH―=2AlO2―+4H2O
6H2O+6e―=6OH―+3H2↑
B
负极
稀盐酸
2Al―6e― = 2Al3+
6H++6e―=3H2↑
C
正极
浓硝酸
Mg + 2e―= Mg2+
2NO3―+4H+-4e―=2NO2↑+2H2O
其中正确的是 (填序号),由此推知,金属作电极不仅与本身性质相关,而且与 有关。
24. (12分)
铜及铜的化合物有多种应用。请回答下面相关问题:
|
 是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:
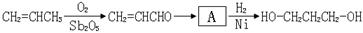
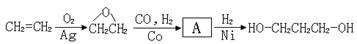 【路线2】环氧乙烷甲酰化法:
【路线2】环氧乙烷甲酰化法: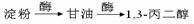
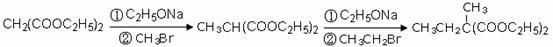
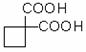
 利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
, 请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
, 请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下: ②(4分)
②(4分)


 ⑴
(或
),
(2分,各1分)
⑴
(或
),
(2分,各1分) ⑵
(1分)
⑵
(1分)


 (4)
(4)