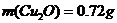2008-2009学年度湖北省补习学校联合体大联考理科综合试题
考试时间:2008年12月29日
相对分子质量:H-1 O-16 K-39 C-12 Na-23 Cu-64 N-14 S-32 Cl-35.5
第Ⅰ卷
(本卷共21小题,每小题6分,126分)
一. 选择题(本题共13个小题,每小题给出的四个选项中只有一项符合题意)
 1.根据如图所示坐标曲线回答,正确的是
1.根据如图所示坐标曲线回答,正确的是
A.如果横坐标代表一天的时间,纵坐标代表密闭温室中的CO2浓度,则温室中植物光合作用开始于B点
B.如果该曲线表示健康成年人体内血糖浓度的动态变化,进食后血糖会从A上升到B,此时体内含量上升的激素是胰高血糖素和肾上腺素
C.如果该曲线表示谷氨酸棒状杆菌体内谷氨酸合成速率的变化,BC段下降是由于细胞内谷氨酸过多而抑制了谷氨酸脱氢酶的活性
D.如果该曲线表示紫色洋葱鳞片叶细胞液泡体积的大小变化,则CD段上升表示该细胞吸水能力逐渐增强
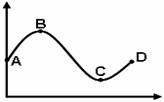
2.下列坐标曲线中,a、b所表示的含义正确的是
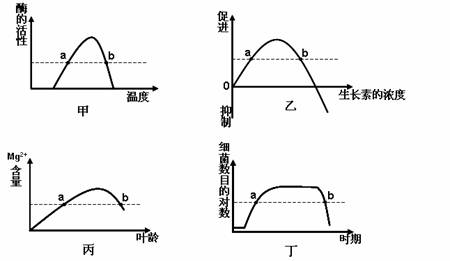
A.图甲中,a、b点酶的结构、功能相同
B.图乙中,a、b点生长素的生理效应相同
C.图丙中,a、b点细胞的代谢强度相同
D.图丁中,a、b点细菌的生长速率相同
3.在适宜温度和PH条件下,下列实验能够实现实验目的是
A.离体的线粒体在含葡萄糖的培养液中能产生CO2
B.向经研磨和离心处理获取的叶绿体基质中通入CO2后能生成较多的葡萄糖等有机产物
C.植物生长素和动物促甲状腺激素都能与双缩脲试剂发生反应,生成紫色
D.经研磨和离心处理获取的乳酸菌细胞质基质中加入葡萄糖后产生ATP
4.下图示人体内的细胞在分裂过程中每条染色体DNA分子含量的变化曲线(横坐标表示细胞分裂时期,纵坐标表示每条染色体中的DNA分子含量)。下列有关叙述中,正确的是
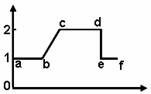 A.若该图表示有丝分裂,则染色体的交叉互换和基因重组都发生在ac时期
A.若该图表示有丝分裂,则染色体的交叉互换和基因重组都发生在ac时期
B.若该图为减数分裂,则cd时期的每个细胞都含有23对同源染色体
C.de时期表明同源染色体发生了分离
D.在ac时期细胞核中发生了DNA解旋,DNA转录和翻译等过程
5.在两个相同的密闭、透明玻璃室内各放置一盆长势相似的甲、乙两种植物幼苗,在充足的水分、光照和适宜的温度等条件下,用红外线测量仪定时测量玻璃室内的CO2含量,结果如下表(假设实验期间光照、水分和温度等条件恒定不变)。下列有关分析,错误的是
记录时间(min)
0
5
10
15
20
25
30
35
40
45
甲种植物(mg/L)
150
113
83
58
50
48
48
48
48
48
乙种植物(mg/L)
150
110
75
50
30
18
8
8
8
8
A.在0 ~ 25min期间,影响光合速率的主要因素是CO2浓度
B.上表数据说明,甲植物比乙植物固定CO2的能力强
C.在0 ~ 25min期间,甲和乙两种植物光合速率都逐渐减小
D.在30 ~ 45min期间,甲、乙两种植物仍然在进行光合作用
6.2007 年诺贝尔化学奖得主―德国科学家格哈德.埃特尔对有关一氧化碳在金属铂表面的氧化过程的研究,催生了汽车尾气净化装置。净化装置中的催化转化器,可将 CO、NO、NO2 和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害。下列有关说法不正确的是
A.催化转化器中的铂催化剂可加快 CO 氧化
B.铂表面做成蜂窝状更有利于提高催化效果。
C.在铂催化下,NO、NO2 可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
7.由于工业发展,水资源的污染日益严重,水的净化处理一直受到高度重视。某些含Al3+、Fe3+的化学试剂可用于净水,如聚合硫酸铁,其化学式为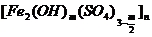 ,式中m不可能为
,式中m不可能为
A.6 B.4 C.3 D.2
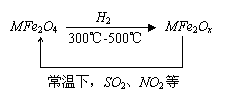 8.新型纳米材料氧缺位铁酸盐(MFe2OX)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它使能工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,有关上述转化过程的下列叙述正确的是
8.新型纳米材料氧缺位铁酸盐(MFe2OX)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它使能工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,有关上述转化过程的下列叙述正确的是
A.MFe2O4表现了还原性
B.MFe2OX表现了还原性
C.SO2和NO2表现了还原性
D.SO2和NO2发生了分解反应
9.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将
A.肯定含有KNO3,可能含有Na2CO3
B.肯定没有Ba(NO3)2,可能会有KNO3
C.肯定没有Na2CO3和Ba(NO3)2
D.肯定含有Na2CO3和KNO3
10.向0.1mol/L的CH3COOH溶液中分别加入任意浓度的下列溶液,一定能抑制CH3COOH的电离的是 ①盐酸 ②NaOH ③CH3COONa ④NaCl
A.①③ B.①②③
C.①②③④ D.前三个选项均错
11.下列对一些氢化物的沸点的比较中,错误的是
A.H2O>H2Te>H2Se>H2S B.HF>HI>HBr>HCl
C.SbH3>NH3>AsH3>PH3 D.H2O>NH3>HF>CH4
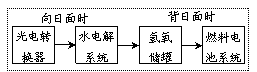 12 .右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
12 .右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阴极反应:2H2O+2e-=H2↑+2OHˉ
D.燃料电池放电时的负极反应:H2-2e-+2OHˉ=2H2O
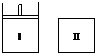 13.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol
X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?)
13.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol
X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ<Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于VL
二、选择题(本题共8个小题,每个小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,有选对但不全的得3分,有选错的得0分)
14.根据热力学定律和分子动理论,下列说法正确的是:
A.布朗运动是液体分子的运动,说明分子在做永不停息的无规则运动
B.密封的容积不变的容器,温度升高,则气体分子对器壁单位面积上的平均作用力增大
C.第二类永动机不可能制造成的原因是因为违背了能的转化和守恒定律
D.根据热力学第二定律知:热量能够从高温物体传到低温物体,但不可能从低温物体传到高温物体
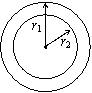 15.如图,火星和地球绕太阳的运动可以近似看作为在同一平面内的同方向的匀速圆周运动,已知火星轨道半径r1=2.3×
15.如图,火星和地球绕太阳的运动可以近似看作为在同一平面内的同方向的匀速圆周运动,已知火星轨道半径r1=2.3×
A.1年 B.2年 C.3年 D.4年
16.物体作方向不变的直线运动,若在任意相等位移内速度变化量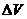 相等,则下列说法中正确的是:
相等,则下列说法中正确的是:
A.若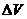 =0,则物体作匀速直线运动
=0,则物体作匀速直线运动
B.若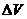 >0,则物体作匀加速直线运动
>0,则物体作匀加速直线运动
C.若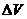 >0,则物体作加速度逐渐变大的加速直线运动
>0,则物体作加速度逐渐变大的加速直线运动
D.若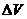 <0,则物体作加速度逐渐变大的减速直线运动
<0,则物体作加速度逐渐变大的减速直线运动
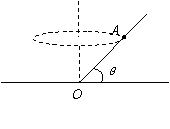 17.如图,水平圆盘中心O处焊接一光滑直杆,杆与盘夹角为
17.如图,水平圆盘中心O处焊接一光滑直杆,杆与盘夹角为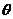 ,杆上套一小球,当圆盘绕通过中心O的竖直轴以角速度ω匀速转动时,小球在杆上A处刚好相对静止,若使圆盘转动角速度增至2ω,则:
,杆上套一小球,当圆盘绕通过中心O的竖直轴以角速度ω匀速转动时,小球在杆上A处刚好相对静止,若使圆盘转动角速度增至2ω,则:
A.小球仍将在A处,与杆相对静止转动
B.小球将在A处上方某处,与杆相对静止转动
C.小球将在A处下方某处,与杆相对静止转动
D.小球将不能与杆相对静止
 18.如图所示,在一条直线上两个振源A、B相距
18.如图所示,在一条直线上两个振源A、B相距
A.在两列波相遇过程中,中点C为振动加强点
B.两列波的波长都是
C.两列波在A、B间的传播速度均为
D. t2=0.7s时刻B点经过平衡位置且振动方向向上
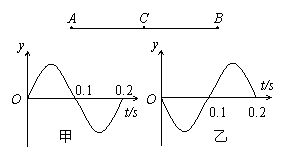
 19.如图所示,物体放在轻弹簧上,沿竖直方向在A、B之间做简谐运动,物体沿DC方向由D点运动到C点(D、C两点未在图上标出)的过程中,弹簧的弹性势能减少了3.0J,物体的重力势能增加了1.0J,则在这段过程中
19.如图所示,物体放在轻弹簧上,沿竖直方向在A、B之间做简谐运动,物体沿DC方向由D点运动到C点(D、C两点未在图上标出)的过程中,弹簧的弹性势能减少了3.0J,物体的重力势能增加了1.0J,则在这段过程中
A.物体经过D点时的运动方向是指向平衡位置的
B.物体的动能增加了4.0J
C.C点的位置一定在平衡位置以下
D.物体的运动方向可能是向下的
20.空间有平行于纸面的匀强电场,一电量为-q的质点(不计重力),在恒力F的作用下沿图中虚线从静止开始由M运动到N,如图。已知力F与MN的夹角为θ,M、N间距为d,则
A.匀强电场的场强最小值为Fsinθ /q
B.质点由M运动到N的过程中,电势能增加
C.M、N两点的电势差的数值可能为Fdcosθ/q
D.质点运动到N点时,如果只改变F的方向不可能使质点做匀速直线运动
21.如图甲所示,一轻弹簧与质量分别为m1和m2的两物块A、B相连接,并静止在光滑的水平面上,现使A瞬时获得水平向右的速度
A.在t1、t3时刻两物块达到共同速度
B.从t3到t4时刻弹簧由压缩状态恢复到原长
 C.两物体的质量之比为m1:m2=1:2
C.两物体的质量之比为m1:m2=1:2
D.在t2时刻A与B的动能之比为Ek1:Ek2=1:8
第Ⅱ卷
(本卷共10小题,174分)
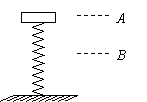
22.(18分)Ⅰ.(7分)在一次课外活动中,某同学用图甲所示装置测量放在水平光滑桌面上铁块A与金属板B间的动摩擦因数。已知铁块A的质量mA=
 |
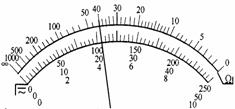 Ⅱ.(11分)一额定功率为0.01W的电阻,其阻值不详。用欧姆表粗测其阻值结果如图所示(档位上×1K)。现有下列器材,试设计适当的电路,选择合适的器材,较精确地测定其阻值(滑动变阻器的调节要方便)。
Ⅱ.(11分)一额定功率为0.01W的电阻,其阻值不详。用欧姆表粗测其阻值结果如图所示(档位上×1K)。现有下列器材,试设计适当的电路,选择合适的器材,较精确地测定其阻值(滑动变阻器的调节要方便)。
A.电流表,量程0~400μA,内阻150Ω
B.电流表,量程0~10mA,内阻45Ω
 C.电压表,量程0~3V,内阻6KΩ
C.电压表,量程0~3V,内阻6KΩ
D.电压表,量程0~15V,内阻30KΩ
E.干电池两节,每节电动势为1.5V
F.直流稳压电源,输出电压6V,额定电流
G.直流稳压电源,输出电压24V,额定电流
H.滑动变阻器,0~50Ω,
I.滑动变阻器,0~4KΩ,
J.电键一只,导线若干
①欧姆表测得的电阻值约为 Ω;
②电流表应该选择 ,电压表应该选择 ,电源应该选择 ,滑动变阻器最好选择 (填字母代号);
③在方框中画出电路原理图。
23.(16分)如图所示,光滑水平面上静止放着长L=
 (1)施力F后要想把木板从物体m的下方抽出来,求力F的大小应满足的条件。
(1)施力F后要想把木板从物体m的下方抽出来,求力F的大小应满足的条件。
(2)如果所施力F=10N,为了把木板从m的下方抽出来,此力的作用时间不得少于多少?
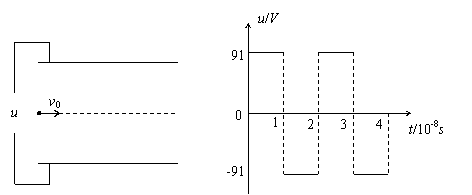
24.(18分)一电子(质量m=0.91×10
(1)电子离开极板时的动能为多少eV。
(2)极板的长度L。
 25.(20分)如图所示,一轻绳穿过光滑的定滑轮,两端各拴一小物块,它们的质量分别为m、M,已知M=
25.(20分)如图所示,一轻绳穿过光滑的定滑轮,两端各拴一小物块,它们的质量分别为m、M,已知M=
(1)M从释放开始到第一次着地所用时间
(2)M第3次着地时系统损失的机械能与绳第3次绷直时系统损失的机械能之比
(3)M所走的全部路程(取三位有效数字)
26.(17分 )亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
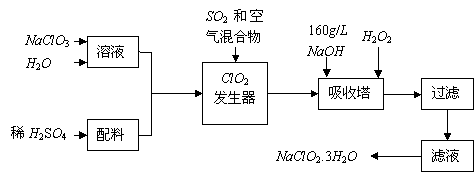
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2.3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1 L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2.3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO23H2O晶体必须进行的操作是 (填操作名称)。
27.(共15分)已知由短周期元素组成的A、B、C、D四种化合物所含原子数目依次为2、3、4、5,其中A、B、C含有18个电子,D含有10个电子。请回答
(1)A、B、D的化学式分别是A ;B ;D
(2)已知8gD与O2完全反应,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式
(3)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,写出化学方程式
若C为第一和第二周期元素组成的化合物。
①C的溶液中加入少量的二氧化锰,有无色气体生成,写出化学方程式
②C的溶液中加入足量二氧化锰和稀硫酸,二氧化锰逐渐溶解生成Mn2+,反应中二氧化锰做 剂
③当C分别发生①和②两个反应时,若都有1molC完全反应,①和②两个反应中转移电子数之比是:
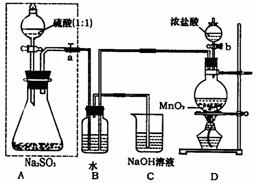 28.(15分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
28.(15分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,
则应该怎样检查虚线框内装置的气密性? 。
(2)D装置中反应的化学方程式为
。B装置中反应的离子方程为 。
(3)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为 。
(4)为保证实验测定的准确性,则C装置中反应的离子方程式为 。
(5)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度
。
|
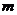
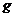 Cu(NO3)2强热使其分解得到NO2和O2,还有
Cu(NO3)2强热使其分解得到NO2和O2,还有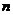
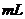 溶液,则该溶液物质的量浓度为_________mol.L-1(用含
溶液,则该溶液物质的量浓度为_________mol.L-1(用含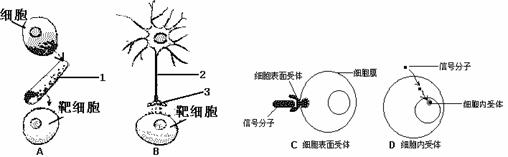
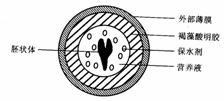 (4)目前通过生物技术可以生产如图所示的人工种子,制造人工种子的原理是在植物组织培养得到的“胚状体”的最外面用一层有机膜包裹,并在薄膜以内放入一些营养物质,这层膜和这些营养物质分别具有种皮和胚乳的功能,在制造过程中还可以加入某些农药、菌肥等。由离体的植物体细胞形成胚状体的过程中要经过的两个重要的生理过程是______________________和______________________,在这一过程中被培养的细胞始终受______
的调节。
(4)目前通过生物技术可以生产如图所示的人工种子,制造人工种子的原理是在植物组织培养得到的“胚状体”的最外面用一层有机膜包裹,并在薄膜以内放入一些营养物质,这层膜和这些营养物质分别具有种皮和胚乳的功能,在制造过程中还可以加入某些农药、菌肥等。由离体的植物体细胞形成胚状体的过程中要经过的两个重要的生理过程是______________________和______________________,在这一过程中被培养的细胞始终受______
的调节。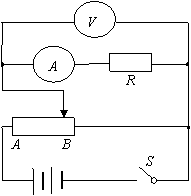 ③ 如图所示
③ 如图所示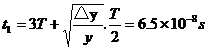 …………….. ..(3分)
…………….. ..(3分)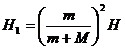 ……….(2分)
……….(2分)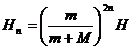 ……….(2分)
……….(2分)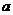 (2分)
(2分)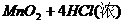 ====
====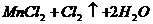 (2分)
(2分)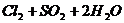 ====
====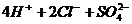 (2分)
(2分)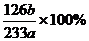 (3分)
(3分)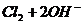 ====
====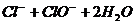 (2分)
(2分)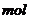 ?L-1 (3分)
?L-1 (3分)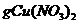 的物质的量为
的物质的量为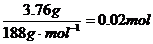 ,若分解得到的固体产物全部为
,若分解得到的固体产物全部为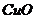 ,则m(残渣)=
,则m(残渣)=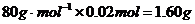 ,若
,若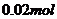
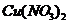 分解生成的残渣为
分解生成的残渣为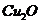 ,则m(残渣)=
,则m(残渣)=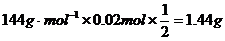
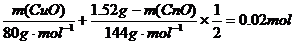
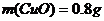 ,
,