摘要:13.如图.Ⅰ是恒压密闭容器.Ⅱ是恒容密闭容器.其它条件相同时.在Ⅰ.Ⅱ中分别加入2mol X和2mol Y.起始时容器体积均为V L.发生如下反应并达到平衡+Y(?)aZ(g).此时Ⅰ中X.Y.Z的物质的量之比为1∶3∶2.则下列说法一定正确的是A.若X.Y均为气态.则平衡时气体平均摩尔质量:Ⅰ<ⅡB.若X.Y不均为气态.则平衡时气体平均摩尔质量:Ⅰ>ⅡC.若X为固态.Y为气态.则Ⅰ.Ⅱ中从起始到平衡所需时间相同D.平衡时Ⅰ容器的体积小于VL
网址:http://m.1010jiajiao.com/timu_id_299004[举报]
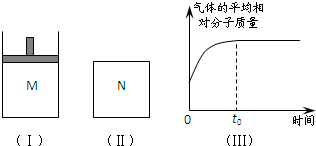 (2008?湖南模拟)如图Ⅰ,在恒压密闭容器M中加入2mol A和2mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?x C(g);△H<0
(2008?湖南模拟)如图Ⅰ,在恒压密闭容器M中加入2mol A和2mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?x C(g);△H<0平衡时A、B、C的物质的量之比为1:3:4,C的物质的量为 y mol.
(1)根据题中数据计算,x=
2
2
、y=1.6
1.6
;(2)如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol.由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
| 可能的情形 | A、B是否为气态 | z与y的大小关系 | M(B)与M(C)的大小关系 (M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | z=y | 无法确定 |
| ② | 是 是 |
是 是 |
y>z y>z |
无法确定 无法确定 |
| ③ | 不是 不是 |
是 是 |
y>z y>z |
M(C)>M(B) M(C)>M(B) |
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
(1)一定温度下,将2mol CO和一定量H2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .
若在相同温度下,上述反应改在体积为2L的恒容密闭容器中进行,平衡常数 (填“增大”“不变”或“减小”);反应10s后CO的物质的量为l.2mol,则0~10s的平均反应速率v(H2)= .
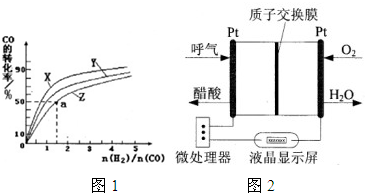
(2)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.
请回答:
①在上述三种温度中,曲线X对应的是 .
②利用图1中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K= .
(3)已知:CO(g)+
O2(g)=CO2(g);△H2=-283kJ?mol-1
H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;
(4)乙醇燃料电池具有很高的实用价值.如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为 .
查看习题详情和答案>>
(1)一定温度下,将2mol CO和一定量H2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

若在相同温度下,上述反应改在体积为2L的恒容密闭容器中进行,平衡常数

(2)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图1是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.
请回答:
①在上述三种温度中,曲线X对应的是
②利用图1中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
(3)已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
(4)乙醇燃料电池具有很高的实用价值.如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为
(2009?湛江一模)在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?xC(g),△H<0.平衡时M中A、B、C的物质的量之比为1:3:4.下列判断正确的是( )


查看习题详情和答案>>
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).

根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
②若在恒温、恒容条件下向上述平衡体系中通He,V正
③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
②工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是
A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g).反应在一定条件下达到平衡时,NH3的体积分数为
.计算:该条件下N2(g)+3H2(g)
2NH3(g)的平衡常数为
④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
400℃时,在2L的密闭容器中2NH3(g)?N2(g)+3H2(g) 的化学平衡常数K的值为
查看习题详情和答案>>
Ⅰ.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).

根据图示回答下列问题:
①2SO2(g)+O2(g)?2SO3(g)的△H
<
<
0.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>
>
K2;若反应进行到状态D时,v正>
>
v逆(填“>”、“<”或“=”).②若在恒温、恒容条件下向上述平衡体系中通He,V正
不变
不变
(填“增大”、“减小”或“不变”);平衡不
不
移动(填“向左”、“向右”或“不”).③若在恒温、恒压条件下向上述平衡体系中通入氦气,V正
减小
减小
,V逆减小
减小
;平衡向左
向左
移动.Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①如图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-2(b-a)kJ?mol-1
(△H的数值用含字母a、b的代数式表示).②工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
AB
AB
.A、增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
③工业合成氨的反应为N2(g)+3H2(g)
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
200
200
;N2的平衡转化率为66.7%
66.7%
.④已知化学反应:N2(g)+3H2(g)?2NH3(g);其化学平衡常数K与温度T的关系如下表:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
2
2
.当测得NH3和N2、H2的物质的量分别为12mol和8mol、4mol时,则该反应的v正(N2)大于
大于
v逆(N2)(填“大于”、“小于”或“等于”) 如图:Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为VL,发生如下反应并达到平衡:aX(?)+2Y(?)?3Z(g).此时II中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )
如图:Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器.其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为VL,发生如下反应并达到平衡:aX(?)+2Y(?)?3Z(g).此时II中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )