摘要:28.(1)关闭弹簧夹.由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面.过一段时间观察液面是否变化.若不变.说明气密性好.否则说明装置漏气 △
网址:http://m.1010jiajiao.com/timu_id_299057[举报]
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定某无水亚硫酸钠试剂的被氧化的程度,设计了如图所示实验装置:

请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?
(2)A装置中反应的化学方程式为
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀b g,原样品中Na2SO3的质量分数为
×100%
×100%.
(4)C装置中反应的离子方程式为
查看习题详情和答案>>

请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?
关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气
关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶内加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性良好,否则,说明装置漏气
.(2)A装置中反应的化学方程式为
H2SO4+Na2SO3═Na2SO4+H2O+SO2↑
H2SO4+Na2SO3═Na2SO4+H2O+SO2↑
.B装置中反应的离子方程式为Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
.(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀b g,原样品中Na2SO3的质量分数为
| 126b |
| 233a |
| 126b |
| 233a |
(4)C装置中反应的离子方程式为
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
、SO2+2OH-═SO32-+H2O
SO2+2OH-═SO32-+H2O
.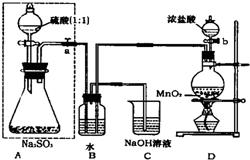 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了如图实验:请回答下面的问题:(1)若将虚线框内的分液漏斗换成长颈漏斗,则应该怎样检查虚线框内装置的气密性?
关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气
关闭弹簧夹(或止水夹)a,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气
.(2)D装置中反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑2H2O
B装置中反应的离子方程为
| ||
Cl2+SO2+2H2O═4H++2Cl-+SO42-
Cl2+SO2+2H2O═4H++2Cl-+SO42-
.(3)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分数为
| 126b |
| 233a |
| 126b |
| 233a |
(4)为保证实验测定的准确性,则C装置中反应的离子方程式为:
Cl2+2OH-═Cl-+ClO-+2H2O
Cl2+2OH-═Cl-+ClO-+2H2O
.(5)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,
①②④
①②④
设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度一定质量的Na2SO3样品于试管中,加入适量的蒸馏水溶解,加入过量的稀盐酸,不再产生气泡,再加入足量的BaCl2溶液充分反应,过滤,洗涤,干燥,称重,求算出被氧化的Na2SO3的量,即可求算出无水亚硫酸钠被氧化的百分含量.
一定质量的Na2SO3样品于试管中,加入适量的蒸馏水溶解,加入过量的稀盐酸,不再产生气泡,再加入足量的BaCl2溶液充分反应,过滤,洗涤,干燥,称重,求算出被氧化的Na2SO3的量,即可求算出无水亚硫酸钠被氧化的百分含量.
.某化学课外活动小组在实验室做了如下一系列实验:
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是
②B中试剂的名称是_
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是
④综上所述:黑色粉末的组成为
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是
(5)通过以上数据,计算黑色粉末中两组分的质量分别为
查看习题详情和答案>>

该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入
H2O2
H2O2
或H2O
H2O
,装置Ⅱ从C
C
管口进气即可作为排气法收集O2的装置.②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法
先往集气瓶中装满水,按照图Ⅱ装置好,C导气管接装置Ⅲ后,从D处导气管通入一氧化氮气体排净集气瓶内的水
先往集气瓶中装满水,按照图Ⅱ装置好,C导气管接装置Ⅲ后,从D处导气管通入一氧化氮气体排净集气瓶内的水
学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
Fe
Fe
,产生气泡的离子方程式为Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是
关闭止水夹K,往长颈漏斗加水至漏斗内的液面高于导气管,静置一段时间后液面差保持不变,说明装置A的气密性良好
关闭止水夹K,往长颈漏斗加水至漏斗内的液面高于导气管,静置一段时间后液面差保持不变,说明装置A的气密性良好
.②B中试剂的名称是_
浓硫酸
浓硫酸
.③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是
是
是
(填“是或否”)含有Fe3O4.④综上所述:黑色粉末的组成为
Fe
Fe
和Fe3O4
Fe3O4
.(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:
不可行,因Fe3O4溶于盐酸生成Fe3+与Fe反应生成Fe2+,溶液不变色
不可行,因Fe3O4溶于盐酸生成Fe3+与Fe反应生成Fe2+,溶液不变色
.(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是
过滤
过滤
、洗涤
洗涤
、转移固体.(5)通过以上数据,计算黑色粉末中两组分的质量分别为
Fe 0.56 Fe3O4 2.32
Fe 0.56 Fe3O4 2.32
.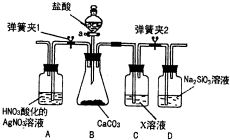 某同学为了验证碳和硅两种元素非金属性的相对强弱,用图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用图所示装置进行实验(夹持仪器已略去,气密性已检验).实验操作步骤:
I.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸.
Ⅱ.A中看到白色沉淀时,…,关闭活塞a.
请回答:
(1)通过步骤I得知盐酸具有的性质是
A.挥发性 B.还原性C.氧化性 D.酸性
(2)C装置的作用是
(3)为了验证碳的非金属性强于硅,步骤Ⅱ中未写出的操作和现象是
(4)碳、硅的非金属性逐渐减弱的原因是
 (2012?朝阳区一模)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).
(2012?朝阳区一模)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸.
Ⅱ.A中看到白色沉淀时,…,关闭活塞a.
请回答:
(1)B中反应的离子方程式是
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
.(2)通过步骤Ⅰ得知盐酸具有的性质是
AD
AD
(填字母).A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是
除HCl气体
除HCl气体
,X是NaHCO3
NaHCO3
(写化学式).(4)为了验证碳的非金属性强于硅,步骤Ⅱ中未写的操作和现象是
关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后
关闭弹簧夹1,打开弹簧夹2,当D中出现白色胶状沉淀后
,D中反应的化学方程式是Na2SiO3+CO2+H2O=H2SiO3(胶体)+Na2CO3
Na2SiO3+CO2+H2O=H2SiO3(胶体)+Na2CO3
.(5)碳、硅的非金属性逐渐减弱的原因是
碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
碳和硅位于同一主族,从上到下,原子半径逐渐增大,得电子的能力减弱,非金属性减弱
(从原子结构角度加以解释).