2009届江苏省泰州市期末联考高三化学模拟试题
可能用到的相对原子质量:H:
第Ⅰ卷(选择题 共64分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1.调味剂是日常生活中离不开的食品添加剂,有关其说法正确的是
A.味精主要成分是谷氨酸钠,向其中加入盐酸适当处理可得谷氨酸,谷氨酸具有两性
B.食醋的主要成分是醋酸,将一定量的醋酸溶液稀释,溶液中各离子的浓度都减小
C.食盐是咸味剂,工业上常用电解饱和食盐水制备氯气和钠
D.木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物
2.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.精炼铜过程中阴极增重
B.通常状况下,将0.5mol HI气体和0.5mol氯气混合后气体的分子数为NA
C.
D.
3.下列说法中错误的是
A.干冰与二氧化硅晶体熔化时,所克服的微粒间相互作用不相同
B.C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高于后者,其原因是前者的分子间存在氢键
C. 非金属单质只能形成分子晶体
D.短周期元素离子 和
和 具有相同的电子层结构,若
具有相同的电子层结构,若 ,则
,则
4.“抓好资源节约,建设环境友好型社会”,是我国社会和经济长期发展的重要保证。你认为下列做法与之不相符的是
A.推广使用乙醇汽油作汽车燃料
B.包装盒、快餐盒等全部用聚苯乙烯生产,以减少木材的使用
C.农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源。
D.研制开发以水代替有机溶剂的化工涂料
5.下列说法错误的是
①测定中和热时,为了减少热量损失,不要搅拌溶液
②银镜反应实验后,粘有银的试管可用稀氨水洗涤
③向氯化铁溶液里滴入氢氧化钠溶液可以制取氢氧化铁胶体
④SO2气体通入溴水,溴水褪色,说明SO2有漂白性
⑤向含有乙酸杂质的乙酸乙酯中加入氢氧化钠溶液后分液,提纯乙酸乙酯
A.①②④⑤ B.①②③ C.②③④ D.全部
|




 A.缺铁 会引起贫血
B.喝加钙奶 补充铁元素
A.缺铁 会引起贫血
B.喝加钙奶 补充铁元素

 缺钙 会得甲状腺肿大
食用碘盐 补充钙元素
缺钙 会得甲状腺肿大
食用碘盐 补充钙元素
 C. 碘 抗癌之星 D.少吃油条 加醋后可长时间炖煮
C. 碘 抗癌之星 D.少吃油条 加醋后可长时间炖煮

 硒 智力之星 治疗胃酸过多 尽量不服用含Al(OH)3的胃舒平
硒 智力之星 治疗胃酸过多 尽量不服用含Al(OH)3的胃舒平 氟 龋齿克星 使用铝锅 因油条中含有明矾
氟 龋齿克星 使用铝锅 因油条中含有明矾 2SO3(g)
;△H < O 在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件制取SO3,采取加压措施的目的是
2SO3(g)
;△H < O 在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件制取SO3,采取加压措施的目的是 15.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
15.如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是  =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是 (3)在步骤③测量气体体积时,必须待试管和量筒内的气体都
(3)在步骤③测量气体体积时,必须待试管和量筒内的气体都  (1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
 20.(10分)下图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体。
20.(10分)下图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,E、G在常温常压下是气体。 H++A―,则K==
H++A―,则K==
 CH3COO―+H+
CH3COO―+H+ H++HCO3―
H++HCO3― H++H2PO4―
H++H2PO4― H++HPO42―
H++HPO42― H++PO43―
H++PO43― 22. (8分)(I) 假若某大分子,分子内只含 C、H、P三种元素,其最
22. (8分)(I) 假若某大分子,分子内只含 C、H、P三种元素,其最 
 (R、R'代表烷基或H原子)发生缩合反应生成新的有机物和水。
(R、R'代表烷基或H原子)发生缩合反应生成新的有机物和水。





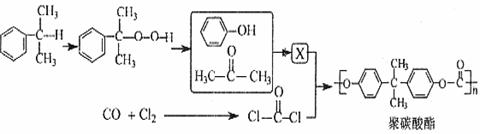
 反应合成聚碳酸酯的化学方程式(不必写反应条件):
反应合成聚碳酸酯的化学方程式(不必写反应条件): 互为同分异构体的有机物有 种。
互为同分异构体的有机物有 种。 18.
18. Si+2CO↑(1分)
Si+2CO↑(1分) 2Cu+4H++O2↑(2分)
2Cu+4H++O2↑(2分)
 22.(8分)(I)C2nH3nPn
。
22.(8分)(I)C2nH3nPn
。 (3分) (2)略(3分) (3)4(2分)
(4)7(2分)
(3分) (2)略(3分) (3)4(2分)
(4)7(2分)
 =0.03mol (1分) 依题意可得:
=0.03mol (1分) 依题意可得: n(C6H5OH)+2×n(A)=0.03mol
n(C6H5OH)+2×n(A)=0.03mol  ×100%=40.5%(或0.405) (2分)
×100%=40.5%(或0.405) (2分) (2分)
(2分)