网址:http://m.1010jiajiao.com/timu_id_235269[举报]
一、选择题(每小题4分,共32分)
题号
1
2
3
4
5
6
7
8
答案
A
B
C
D
D
B
C
C
二、选择题(每小题4分,共32分)
题号
9
10
11
12
13
14
15
16
答案
B
BD
AD
B
BD
C
AD
AD
三、(本题包括2小题,共22分)
17.(每小条2分)(1)150mL,气体体积为110mL,量筒的量程越小,产生的误差越小;
(2)酸式滴定管,酸性KMnO4具有强氧化性,能腐蚀碱式滴定管的乳胶管;
(3)B,防止气体冷却时发生倒吸现象;此时读数由于量筒中气体压强小于外界大气压,使读的气体体积偏大,Na2O2纯度偏高;应慢慢把量筒往下移,使量筒中液面恰好与水槽中液面相平;
(4)溶液刚好出现浅紫红色,并在半分钟内不褪色;
(5)62.4%
 18.
18.
四、(本题包括2小题,共18分)
19.(1)S1>S3>S2>S4(2分)(2)①b ②c (各1分,共2分)
(3)①HClO4(1分)②离子键、(极性)共价键(1分) NaClO(1分)
③SiO2+2C Si+2CO↑(1分)
Si+2CO↑(1分)
20.(1)D为FeSO4(2分),E为H2S (2分)
(2)离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SO42-(2分)
(3)离子方程式2Cu2++2H2O 2Cu+4H++O2↑(2分)
2Cu+4H++O2↑(2分)
(4)称一定量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(2分)
五、(本题包括1小题,共10分)
21.(1)温度升高,促进电离,所以K值增大(2分)
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强(2分)
(3)H3PO4 HPO42―(2分)
(4)K1:K2:K3≈1:10―5:10―10 (2分) 上一级电离产生的H+对下一级电离有抑制作用 (2分)
六、(本题包括2小题,共18分)

 22.(8分)(I)C2nH3nPn
。
22.(8分)(I)C2nH3nPn
。
(II)C20H30O2,
23.(10分)
(1) (3分) (2)略(3分) (3)4(2分)
(4)7(2分)
(3分) (2)略(3分) (3)4(2分)
(4)7(2分)
七、(本题包括2小题,共18分)
24.(6分)(1)44 (2分) (2)A分子中含一个羟基和一个羧基,1molA消耗2molNaOH n(HCl)= 0.02 L×0.100mol/L= 0.002mol (1分) 。苯酚与A的混合物消耗的NaOH物质的量为:0.05L×1.000mol/L―0.002mol× =0.03mol (1分) 依题意可得:
=0.03mol (1分) 依题意可得:
 n(C6H5OH)+2×n(A)=0.03mol
n(C6H5OH)+2×n(A)=0.03mol
94 g/mol×n(C6H5OH)+138g/mol×n(A)=2.32 g
n(C6H5OH)=0.01mol m(C6H5OH)=0.94g
w (C6H5OH)= ×100%=40.5%(或0.405) (2分)
×100%=40.5%(或0.405) (2分)
25.⑴(共4分)NaOH+HCl=NaCl+H2O NH3+HCl=NH4Cl
20.00mLB溶液消耗0.1000mol?L-1NaOH 30.00mL。
20.00mLB溶液中过量的HCl:n(HCl)=0.003000mol ,
100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol
故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol(2分)
[Co(NH3)xCly]Clz中氮元素的质量分数
 (2分)
(2分)
⑵(共6分)I2+2Na2S2O3==2NaI+Na2S4O6
因反应用去0.1000mol?L-1Na2S2O3溶液20.00mL,推算出:n(I2)=0.001000mol(1分)
Co与Fe同一族,Com+具有强氧化性,故设m=3
则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol (1分)
0.5010g样品中Cl的总质量为:
m(Cl)=0.5010g-0.002000molx59g?mol -1-0.01000molx17g ?mol -1=0.2130g
n(Cl)=0.006000mol(1分)
又有:[Co(NH3)xCly]Clz+zAgNO3==[Co(NH3)xCly](NO3)z+zAgCl↓
0.2505g样品扩大一倍来算(即用0.5010g)推算出:
反应消耗AgNO3:n(AgNO3)=0.1000mol?L-1x40.00mL=0.004000mol
即发生上述反应的Cl-为:n(Cl-) =0.004000mol(1分)
则有 y:z=(0.006000mol-0.004000 mol): 0.004000mol=1:2
同时还有:1:x:(y+z)= 0.002000: 0.01000: 0.006000=1:5:3
解得:x=5 y=1 z=2
带入[Co(NH3)xCly]Clz中,求得Co化合价为:+3 假设成立
该钴化合物的化学式为:[Co(NH3)5Cl]Cl2(3分)
答:⑴[Co(NH3)xCly]Clz中氮元素的质量分数为27.94%
⑵该钴化合物的化学式为:[Co(NH3)5Cl]Cl2
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
已知:(I)R1-CH=CH-R2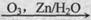 R1-CHO+R2-CHO
R1-CHO+R2-CHO
(Ⅱ)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:

(1)F的名称是 ,C中含有的官能团的名称是 ,H的结构简式为 .
(2)B的核磁共振氢谱图上峰的个数是 .
(3)③的反应条件是 .
(4)写出下列反应类型:⑥ ,⑨ .
(5)写出⑩反应的化学方程式 .C与足量银氨溶液反应的化学方程式 .
(6)1mol有机物B与足量CH3C18OOH在一定条件下完全反应时,生成的有机物的结构简式可能为(如有18O请标示) .
查看习题详情和答案>>
环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以做内燃机的抗冻剂,J分子中无饱和碳原子。
已知:(I)R1-CH=CH-R2 R1-CHO+R2-CHO
R1-CHO+R2-CHO
(Ⅱ)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:
(1)F的名称是 ,C中含有的官能团的名称是 ,H的结构简式为 .
(2)B的核磁共振氢谱图上峰的个数是 .
(3)③的反应条件是 .
(4)写出下列反应类型:⑥ ,⑨ .
(5)写出⑩反应的化学方程式 .C与足量银氨溶液反应的化学方程式 .
(6)1mol有机物B与足量CH3C18OOH在一定条件下完全反应时,生成的有机物的结构简式可能为(如有18O请标示) .
已知:(I)R1-CH=CH-R2
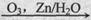 R1-CHO+R2-CHO
R1-CHO+R2-CHO(Ⅱ)羧酸与醇发生酯化反应,通常有不稳定的中间产物生成。例如:
(1)F的名称是 ,C中含有的官能团的名称是 ,H的结构简式为 .
(2)B的核磁共振氢谱图上峰的个数是 .
(3)③的反应条件是 .
(4)写出下列反应类型:⑥ ,⑨ .
(5)写出⑩反应的化学方程式 .C与足量银氨溶液反应的化学方程式 .
(6)1mol有机物B与足量CH3C18OOH在一定条件下完全反应时,生成的有机物的结构简式可能为(如有18O请标示) .
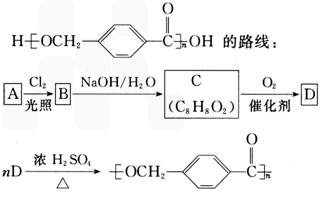
①A的相对分子质量小于110,其中碳的质量分数约为0.9;
②同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
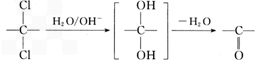
请根据以上信息回答下列问题:
(1)A的分子式为_______________;
(2)由A生成B的化学方程式为_______________,反应类型是____________;
(3)由B生成C的化学方程式为_________________,该反应过程中生成的不稳定中间体的结构简式应是__________________
(4)D的结构简式为___________,D的同分异构体中含有苯环且水解产物之一为乙酸的有_______________________(写结构简式)。
(5)已知①RX+Mg
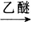 RMgX,
RMgX, 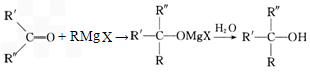
(1)
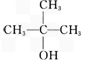 (2)
(2)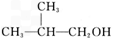 的反应流程图。
的反应流程图。提示:
①合成过程中无机试剂任选;
②只选用本题提供的信息和学过的知识;
③合成反应流程图表示方法示例如下:由乙醇合成二溴乙烷的反应流程图可表示为
CH3CH2OH
 CH2=CH2→CH2BrCH2Br
CH2=CH2→CH2BrCH2Br __________________________________
(1)下图中能够说明运动员在短跑从开始到结束后血液乳酸浓度变化的曲线是________。

(2)人体剧烈运动后,往往会感到肌肉酸痛,其原因是肌肉中________。
(3)取9.0g乳酸与足量金属钠反应,可产生2.24L气体(标准状况)。另取9.0g乳酸与等物质的量的乙酸反应,生成0.01 mo1乳酸乙酯和1.8g H2O。乳酸在铜作催化剂时,可氧化生成物质X,向X中加入碱和银氨溶液微热,无银镜产生。由以上实验可确定X的结构简式是________,乳酸的结构简式是________。
(4)近年来,乳酸成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。利用乳酸聚合而成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中,都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
①写出乳酸在一定条件下发生缩聚反应的化学方程式:________________。
②用乳酸聚合纤维(聚乳酸)非常适合于做手术缝合线,尤其是做人体内部器官的手术,试分析其中的原因________________________。
③试从生物学物质循环的角度解释利用乳酸合成高分子材料,对于环境有什么重要的意义?________________________________。
查看习题详情和答案>>