2008学年第一学期期中考查试题
高三化学
考生须知:
1.本卷试题分为第I卷、第II卷,满分100分,考试时间100分钟。
2.本卷答题时不得使用计算器,不得使用修正液(或涂改液)、修正带。
3.答题时将答案均填在答卷相应题号的位置,不按要求答题或答在草稿纸上无效。
4.可能用到的相对原子质量:H
第I卷(选择题,共48分)
一.选择题(本题包括24小题,每小题2分,共48分。每小题只有一个选项符合题意。)
1.正确掌握化学用语和化学基本概念是学好化学的基础。下列各项中表达正确的是

 A.NaCl的电子式:
A.NaCl的电子式:
 B.H2O分子的分子结构模型示意图:
(三个原子在同一直线上)
B.H2O分子的分子结构模型示意图:
(三个原子在同一直线上)
C.CrO5的结构式为 ,该氧化物中Cr为+6价
D.次氯酸的结构式:H-Cl-O
2.用右图表示的一些物质或概念间的从属关系中不正确的是
X
Y
 Z
Z
A
苯的同系物
芳香烃
芳香族化合物
B
胶 体
分散系
混合物
C
电解质
离子化合物
化合物
D
碱性氧化物
金属氧化物
氧化物
3.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
4.下列过程中,不涉及化学变化的是
A.蛋白质溶液加入CuSO4溶液产生沉淀 B.纸层析法分离Fe3+和Cu2+
C.淀粉遇碘变蓝 D.苯酚与FeCl3溶液显紫色
5.
A.
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
6.某元素的原子最外层有2个电子,则这种元素是
A.金属元素 B.惰性气体元素
C.第二主族元素 D.以上叙述都可能
7.NA表示阿伏加德罗常数,以下说法正确的是
A.
B.在通常条件下,1mol氩气含有的原子数为2NA
C.在标准状况下,
D.含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为
8.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
A.1 molNO2在反应中转移的电子为4mol B.HNCO是一种很强的氧化剂
C.C3N3(OH)3与HNCO为同一物质 D.反应中NO2是还原剂
9.下列说法正确的是
A.同一条件下,不同物质的量浓度的氨水的电离程度是相同的
B.强电解质都是离子化合物,弱电解质都是共价化合物
C.反应能否自发进行与温度有关
D.能自发进行的化学反应,一定是△H>0、△S>0
10.已知aAn+、bB(n+1)+、cC n-、dD(n+1)- 均是由同周期主族元素形成的简单离子。下列叙述正确的是
A.原子序数:a>b>c>d B.离子半径:D>C>A>B
C.原子半径:C>D>A>B D.单质还原性:A>B>C>D
11.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
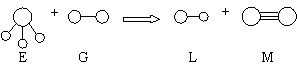
A.G是最活泼的非金属单质 B.L在水中不能完全电离
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
12.下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
13.下列说法正确的是
A.原子晶体中存在共价键,还可能存在离子键或氢键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.非金属元素之间形成的化合物一定是共价化合物
14.在理论上不能用于设计原电池的化学反应是
A. HCl(aq)+NaOH(aq)=NaCl( aq )+H2O(l) △H<0
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H<0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) △H<0
D. 2H2(g)+O2(g)=2H2O(l) △H<0
15.用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是
A.HCl B.NaOH C.Na2SO4 D.NaCl
16.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
 ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
△H=+49.0 kJ?mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)
△H=-192.9 kJ?mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ?mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:
CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9 kJ?mol-1
17.已知:①
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
18.下列事实不能用勒沙特列原理解释的是
A.氨水应密封保存 B.浓硫酸在加热条件下能与铜反应,而稀硫酸不能
C.合成氨生产过程中使用过量氮气以提高氢气的转化率
D.实验室常用排饱和食盐水的方法收集氯气
19.下列各组离子在溶液中能大量共存的是
A.Na+、S2-、OH-、AlO2- B.SO32-、NO3-、H+、K+
C.Fe2+、Cu2+、ClO-、S2- D.H+、Na+、SO42-、S2O32-
20.设某盐酸的pH=x,氨水的pH=y,已知x+y=14,且y>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)>c (Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c (NH4+)>c(H+)>c(OH-)
21.常温下,纯水中存在电离平衡:H2O H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是
A.H2SO4
B.AlCl
22. 下列离子方程式书写正确的是
A.碳酸氢镁溶液中加入足量的石灰水
Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
B.在碳酸氢钙溶液中加入少量苛性钾溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
C.K2S溶液显碱性的原因:S2-+H2O=HS-+OH-,HS-+H2O=H2S+OH-
D.醋酸跟氢氧化钾溶液反应:H++OH―=H2O
23.c1、c 2、α 1、α 2、pH1、pH2分别表示两种一元弱酸的物质的量浓度、电离度和溶液的pH。如果已知pH1>pH2,α l>α 2,则c1和c 2的关系
A.c1>c2 B.c1=c
24.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g) xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是
xC(g) 有图I所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数)。试判断对图II的说法中正确的是
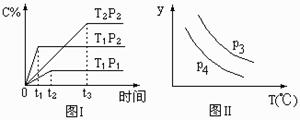
A.P3>P4,y轴表示B的百分含量 B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的密度 D.P3>P4,y轴表示混合气体的平均摩尔质量
第II卷(共52分)
【考生注意】第25题分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
二.简答题(本大题包括5小题,共45分。)
25.(A题,8分)
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外有三个电子层,最外层电子数比次外层少1;乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),写出可以验证该结论的一个化学反应方程式 。
|

 2008学年第一学期期中考查答题卷
2008学年第一学期期中考查答题卷 NH3?H2O+H+ (写成“=”不给分)。
NH3?H2O+H+ (写成“=”不给分)。 Cu+Br2 (2分) 。
Cu+Br2 (2分) 。