河南省南阳市部分高中2009届高三上学期期中考试
化学试题
说明:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,总分100分,考试时间90分钟
2.必须将第Ⅰ卷选择题答案填入第Ⅱ卷的答题栏内,考试结束只交第Ⅱ卷。
可能用到的相对原子质量:H1 N14 O16 Na23 Cl35.5 K39
第Ⅰ卷(选择题48分)
一.选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
2.A.B.C.D是四种短周期元素,已知A.C同主族, A的气态氢化物比C的气态氢化物稳定; B的阳离子比D的阳离子氧化性强,若B的阳离子比C的阴离子少一个电子层,下列比较不正确的是( )
A.原子序数:C>B>D>A B.原子半径:D>B>C>A
C.单质熔点:D>B,C>A D.简单离子半径:C>A>D>B
3.下列反应的离子方程式正确的是( )
①硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于稀醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氟气与水反应:F2+H2O=H++F-+HFO
⑤小苏打溶液中加入少量石灰水:Ca2++2OH- +2HCO3-=CaCO3↓+CO32-+2H2O
⑥次氯酸钙溶液中通入过量CO2: Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦钠与硫酸铜溶液反应: Cu2++2Na=Cu+2Na+
⑧氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
⑨纯碱溶液中滴加少量盐酸: CO32-+H+= HCO3-
A.①②⑤⑨ B.⑨③⑤⑨
C.④⑤⑥⑦ D.②③⑧⑨
4.硫代硫酸钠可作为脱硫剂,已知25.0mL 0.100mol/LNa2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-离子将转化成( )
A.S2- B.S
C.SO32- D.SO42-
5.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出.则该溶液中可能大量存在的一组离子是( )
A.K+.H+.NO3-.Na+ B. H+.Br-.SO42-.Na+
C.SO42-.Br-.OH-.Fe3+ D. H+.Br-.SO32-.K+
6.已知反应:①101Kpa时,
下列结论正确的是( )
A.碳的燃烧热大于110.5KJ/mol
B.①的反应热为221KJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3KJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3KJ热量
7. 在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来的温度,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出 B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出 D.溶液中Na+总数减少,有O2放出
8.下列关于氧化物的各项叙述正确的是( )
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物都可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸酐, 与水反应生成碱的氧化物不一定是碱性氧化物 ⑦不能跟酸反应的氧化物一定能跟碱反应
A.①②③④ B.⑤⑥⑦
C.②③⑥⑦ D.③⑥
9.设NA表示阿伏伽德罗常数的值, 下列叙述正确的是( )
A.标准状况下, NA个SO3分子所占的体积约为22.
B.7.8gNa2O2固体中所含离子的总数为0.4NA
A.配制0.1mol?L-1NaOH溶液过程中,将NaOH固体放在滤纸上称量
B.配制0.1mol?L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
C.配制0.1mol?L-1的NaCl溶液时,最后用胶头滴管加水至刻度线
D.配制0.1mol?L-1的HCl溶液时,要将量取浓盐酸的量筒和溶解用的烧杯洗涤
11.相同溶质的两份溶液,一份质量分数为ω1,密度为ρ
A. ρ1=ρ2 B. ρ1>ρ
12.某学生用NaHCO3和KHCO3组成的某混合物与盐酸反应并进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL盐酸
50mL盐酸
50mL盐酸
m(混合物)
9.
15.
27.
V(CO2)(标况)
2.
3.
3.
则下列分析推理中不正确的是( )
A.盐酸的物质的量浓度为3.0mol?L-1
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.
D. 15.
13.2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质,已知硫化羰与二氧化碳的结构相似,却能在氧气中燃烧,下列关于硫化羰的说法正确的是( )
A.COS可用作灭火剂
B.CO2和COS都是非极性分子
C.COS的熔点可能比CO2的熔点低
D.1molCOS在O2中充分燃烧时转移6mol电子
14.几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6.-2
+2
-2
下列叙述正确的是( )
A.R的氧化物对应的水化物可能具有两性
B.L.M的单质与稀硫酸反应的速率:M > L
C.T.Q的氢化物常态下均为无色气体
D.L.Q形成的简单离子核外电子数相等
15.下列叙述正确的是( )
A.分子晶体中一定存在共价键
B.F2.Cl2.Br2.I2的熔沸点逐渐升高与分子间作用力有关
C.含有极性键的化合物分子一定不含非极性键
D.只要是离子化合物,其熔点一定比共价化合物的熔点高
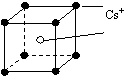 16.已知CsCl晶体的密度为ρg?cm-3, NA为阿伏伽德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为(
)
16.已知CsCl晶体的密度为ρg?cm-3, NA为阿伏伽德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的相对分子质量可以表示为(
)
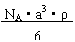 |
A.NA?a3?ρ B.
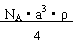 |
|||
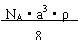 |
|||
C. D.
第Ⅱ卷(非选择题共52分)
二.实验题
17.(10分)某化学实验小组同学为了证明和比较SO2和氯水的漂白性,设计了如下的实验装置。
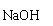
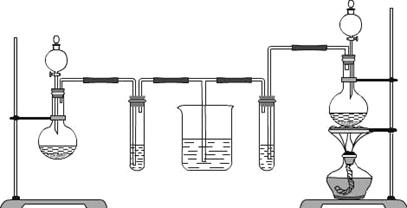
A B C D E
(1)实验室常用装置E制备Cl2,写出反应的离子方程式 。
(2)反应开始后,发现B.D两个试管中的品红溶液都褪去,停止通气后,给B.D两个试管加热,两个试管中的现象分别为B: ,D: 。
(3)装置C的作用是 。
(4)该实验小组的甲.乙两名同学利用上述两发生装置,按下图装置继续进行实验。
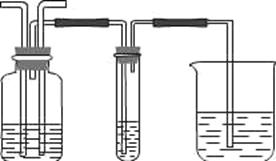
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液的颜色随时间推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答下列问题。
①指出在气体进入品红溶液之前,先将SO2和Cl2通入浓硫酸的目的:
②试分析甲同学实验过程中,品红溶液不褪色的原因
(结合离子方程式说明)。
③你认为乙同学是怎样做到让品红溶液的颜色变得越来越浅的?
三.填空题
 18.(9分)A.B.C.D.E.F六种物质的相互转化关系如下图所示(反应条件均未列出)。
18.(9分)A.B.C.D.E.F六种物质的相互转化关系如下图所示(反应条件均未列出)。
(1)若A.D.F都是非金属单质,且A.D所含元素同主族,A.F所含元素同周期,则物质B的名称是 。E的电子式是 。
(2)若A是常见金属单质,与B的水溶液反应生成C和D。D.F是气体单质。则A所对应的元素在周期表中的位置是 ,反应②(在水溶液中进行)的离子方程式是 。
(3)若A.D为短周期元素所组成的单质,一种为金属,另一种为非金属,且③.④两个反应都有红棕色气体生成,则反应①.④的化学方程式分别为
①
④
19.(8分)已知氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,NaBiO3溶液为无色。取一定量的酸性Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4.H2O2.PbO2氧化性由强到弱的顺序为 ;
(2)实验④中的现象为 ;
(3)实验②③反应的离子方程式分别是: .
。
20.(5分)甲.乙.丙.丁和戊五种溶液,分别由NH4+.K+.Ag+.Ba2+和Cl-.Br-.NO3-.SO42-.CO32-中的一种组成(离子不重复出现)。其中甲.丙.戊三种溶液呈酸性,乙溶液呈碱性,甲和乙反应可生成白色沉淀和气体,丁可分别与甲.乙.丙反应生成白色沉淀。根据上述事实推断上述溶液中溶质的化学式。
甲 乙 丙
丁 戊
21.(10分)现有A.B.C.D四种短周期元素,A元素的原子半径是短周期元素中除稀有气体外半径最大的,B元素的原子最外层比次外层多3个电子,C元素是人体所含元素中质量分数最大的,D元素的一种同位素的质量数与质子数相等。请据此填空:
(1)A的原子结构示意图是 ;B2分子的电子式是 。
(2)C和D可形成电子数相等的两种粒子,该两种粒子反应后生成一种中性分子,反应的离子方程式是 。
(3)C和D形成的两种化合物的结构式分别为 ; 。
(4)用电子式表示A和C形成的碱性氧化物的形成过程 。
(5)A与B形成的一种化合物中,A元素的质量分数约为35.4%,该化合物的摩尔质量不超过
。
四.计算题
22.(10分)实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为:KClO3+HCl―KCl+Cl2↑+H2O
(1)配平上述反应的化学方程式:
KClO3+ HCl == KCl+ Cl2↑+ H2O
(2)浓盐酸在反应中显示出来的性质是 (填写编号)。
①还原性 ②还原性和酸性 ③氧化性 ④氧化性和酸性
(3)若产生0.1mol Cl2,则转移电子的物质的量为 mol。
(4)若反应中HCl的利用率只有50%,当氧化产物比还原产物多7.
题号
1
2
3
4
5
6
7
8
答案
C
C
B
D
B
A
D
D
题号
9
10
11
12
13
14
15
16
答案
D
C
C
D
D
A
B
A
 17.(1)MnO2+4H++2Cl-==Mn2++Cl2↑+2H2O
17.(1)MnO2+4H++2Cl-==Mn2++Cl2↑+2H2O
(2)溶液变为红色并有气泡产生 溶液无明显变化
(3)吸收多余的SO2或Cl2,防止污染空气
(4)①使两种气体充分混合,并通过观察产生气泡的速度控制两种气体的产生速度,使二者按一定比例混合。
②SO2和Cl2按1:1进气,二者发生反应生成无漂白性的H2SO4和HCl: SO2+Cl2+ 2H2O==4H++SO42-+2Cl-
 ③使SO2和Cl2的进气速率不相等。
③使SO2和Cl2的进气速率不相等。
18.(1)二氧化硅 :O::C::O:
 (2)第四周期.第Ⅷ族 2Fe2++Cl2=2Fe3++2Cl-
(2)第四周期.第Ⅷ族 2Fe2++Cl2=2Fe3++2Cl-
 (3)①CO2+2Mg====2MgO+C
(3)①CO2+2Mg====2MgO+C
②C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
19.(1)PbO2>KMnO4>H2O2 (2)溶液紫红色褪去,产生白色沉淀
(3)2MnO4-+5H2O2+6H+==2Mn2++5O2↑+8H2O
5PbO2+2Mn2++4H+==2MnO4-+5Pb2++2H2O

 20.甲:Al2(SO4)3 乙:K2CO3 丙:AgNO3 丁:BaCl2 戊:NH4Br
20.甲:Al2(SO4)3 乙:K2CO3 丙:AgNO3 丁:BaCl2 戊:NH4Br


 21.(1)Na: +11 281 :N N:
(2) H3O++OH-=2H2O (3)H―O―H H―O―O―H
21.(1)Na: +11 281 :N N:
(2) H3O++OH-=2H2O (3)H―O―H H―O―O―H
 (4)Na?+?O?→Na+[:O:]2-Na+
(5)NaN3 离子键.共价键
(4)Na?+?O?→Na+[:O:]2-Na+
(5)NaN3 离子键.共价键
22.(1)1 6―1 3 3 (2)② (3) (4)12mol/L