2008-2009学年度威海市高三年级教学质量调研考试
化学试题
第Ⅰ卷(选择题 共50分)
可能用到的相对原子质量:
H:
一、选择题(本题包括20小题,1―10题每题2分,11―20题每题3分,共50分。每小题只有一个选项符合题意)
1.承担神舟飞船发射任务的长征二号F运载火箭,使用四氧化二氮和偏二甲肼作为推进剂,当引燃后产生大量高温气体从火箭尾部喷出。高温气体成分有CO2、H2O、N2、NO等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量红烟,产生红烟的原因是
A.高温下N2遇空气生成NO2 B.NO与H2O反应生成NO2
C.CO2与NO反应生成NO2 D.NO遇空气生成NO2
2.下列说法不正确的是
A.某地工厂较多,经常处于红棕色烟雾中,估计空气污染物中可能含有Fe2O3粉尘
B.不法分子往奶粉中添加的三聚氰胺(化学式为C3H6N6)属于有机化合物
C.最好喝纯净水,因为纯净水不含任何化学物质
D.运动员大量运动出了很多汗,最好喝含有氯化钠的水,这样可以补充必需的盐分
3.海水淡化可采用膜分离技术。如下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析不正确的是
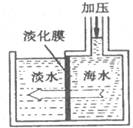
A.钠离子浓度增大 B.溶液质量不变
C.溶剂质量减少 D.溶质质量分数增加
4.下列有关化学史的叙述错误的是
A.我国春秋晚期能炼铁,战国晚期能炼钢
B.法国科学家道尔顿提出了近代原子学说
C.意大利科学家阿佛加德罗提出了分子的概念
D.俄国化学家门捷列大发现了元素周期律
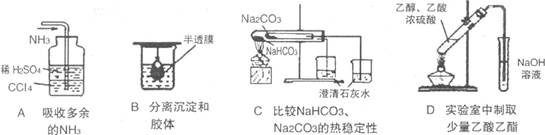
5.用下列实验装置完成对应的实验,能达到实验目的的是
6.已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化
HNO3→NO 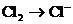
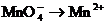 H2O2→H2O如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
H2O2→H2O如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.H2O2 B.Cl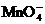 D.HNO3
D.HNO3
7.2008年北京奥运会“祥云”奥运火炬外壳主要采用高品质的铝合金材料制造,燃料选用环保型燃料丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的沸点为-
A.铝合金制作的火炬质量轻、不易腐蚀
B.丙烷燃烧时的耗氧量比等体积的其他烷烃少
C.异丁烷的沸点肯定低于-
D.正己烷在常温常压下肯定不是气体
8.下列离子方程式书写正确的是
A.将SiO2与NaOH溶液混合: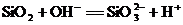
B.Na2S固体加入稀硝酸溶液中: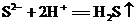
C.等物质的量的KHCO3和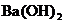 的溶液混合:
的溶液混合:
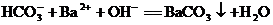
D.氧化铁溶于氢碘酸: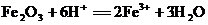
9.用下图表示的一些物质或概念之间的从属或包含关系中正确的是

X
Y
Z
例
氧化物
化合物
纯净物
A
苯
芳香族化合物
芳香烃
B
溶液
分散系
化合物
C
乙醇
烃的衍生物
有机化合物
D
置换反应
氧化还原反应
离子反应
10.下图中 表示相应仪器中加入的试剂,下表中可用下图装置制取、净化、收集的气体是
表示相应仪器中加入的试剂,下表中可用下图装置制取、净化、收集的气体是
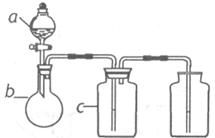
编号
气体
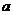
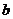
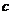
A
SO2
浓H2SO4
铜屑
饱和Na2SO3溶液
B
CO2
稀HNO3
碳酸钙
饱和NaHCO3溶液
C
NO
稀HNO3
铜屑
H2O
D
NO2
浓HNO3
铜屑
NaOH溶液
11.某A物质的化学式为XY2,X、Y为周期表前三周期元素,X的阳离子和Y的阴离子的电子层结构相同,且1molXY2含有30 mol电子。下列说法不正确的是
A.X位于周期表的第三周期第ⅡA族
B.Y为最活泼的非金属,其氢化物的水溶液为强酸
C.X与Y之间形成离子键
D.X在一定条件下可与CO2反应
12.最近媒体报道了一些化学物质,如:爆炸力极强的N5、比黄金还贵的18O2、太空中的甲醇气团等。下列说法中,正确的是
A.18O2和16O2是两种不同的核素,它们互为同素异形体
B.将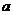 g铜丝灼烧成黑色后趁热插入甲醇中,铜丝变红,质量小于
g铜丝灼烧成黑色后趁热插入甲醇中,铜丝变红,质量小于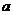 g
g
C.甲醇原子间是通过离子键结合的
D.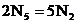 是化学变化
是化学变化
13.标准状况下,某同学向100mL H2S饱和溶液中通入SO2, 所得溶液pH变化如下图所示。下列分析中,不正确的是
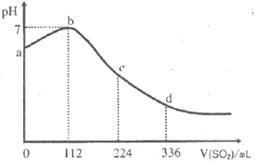
A.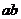 段反应是:
段反应是: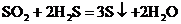
B.亚硫酸是比氢硫酸更强的酸
C.原H2S溶液的物质的量浓度为0.05 mol?L-1
D.SO2在反应中作氧化剂
14.以任意比例将甲和乙两种混合气体同时通入含少量溶质的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
AgNO3
③
CO2
SO2
BaCl2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A.②④ B.②⑤ C.③④ D.②③
15.乙酸橙花酯是一种食用香料,结构如下图所示。下列关于该物质的说法有
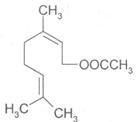
①该化合物属于羧酸类;
②分子式C11H18O2;
③1mol该化合物最多可与2 mol H2反应;
④化合物能发生的反应类型有:加成、取代、氧化、酯化;
⑤该化合物不能有属于酚类的同分异构体。其中正确的是
A.③④ B.②③ C.④⑤ D.③⑤
16.下列有关铁及其化合物的说法中不正确的是
A.分别还原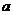 mol Fe2O3所需H2、Al、CO物质的量之比为3┱2┱3
mol Fe2O3所需H2、Al、CO物质的量之比为3┱2┱3
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁质容器储存、运输浓硝酸、浓硫酸
D.检验某物体是否含Fe2O3的操作步骤为:样品→粉碎→加热→溶解→过滤→向滤液中滴加KSCN溶液
17.三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为: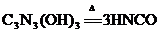 ;
;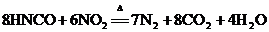 ,下列说法不正确的是
,下列说法不正确的是
A.HNCO是一种很强的氧化剂
B.C3N3(OH)3与HNCO为两种不同的物质
C.1mol NO2在反应中转移的电子为4mol
D.反应中N2是还原产物
18.下图是M、N两种物质的溶解度曲线,在t g M和
g M和 g N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t
g N(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t
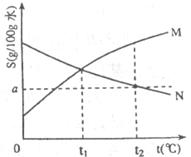
A.t
B.t
C.t
D.t
19.设NA表示阿伏加德罗常数,下列说法正确的是
A.
B.标准状况下,
C.0.1mol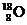 原子中含质子数为NA
原子中含质子数为NA
D.常温常压下,
20.为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[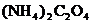 ]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5mol/LKMnO4溶液滴定(生成Mn2+、CO2、H2O),恰好消耗1.6mL,则该病人血液中含钙量为
]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5mol/LKMnO4溶液滴定(生成Mn2+、CO2、H2O),恰好消耗1.6mL,则该病人血液中含钙量为
A.
第Ⅱ卷(非选择题 共50分)
二、(本题包括3小题,共21分)
21.(6分)元素周期表揭示了许多元素的相似性和递变规律,根据元素周期表元素的性质和递变规律,回答下列问题。
(1)1―20号元素中金属性最强的元素与水反应生成的化合物为____________。
(2)写出电子数为18的四种不同形式的微粒(原子、离子、同原子分子、化合物各一种)________________________。
(3)写出原子序数为16的元素阴离子的核外电子排布示意图____________。
22.(10分)根据下列转化关系,回答有关问题。

(1)淡绿色溶液D主要成分的化学式为___________,试剂1的化学式是___________;
(2)下列物质不能作为试剂2的是____________。
a.Cl2 b.新制氯水 c.浓硫酸 d.S e.硝酸
(3)固体A溶于稀盐酸的化学方程式为____________________________________。
(4)溶液C到溶液F红色加深的原因是:____________________________________。
(5)某同学在实验时向E中加入了过量的一种固体物质,发现淡黄色褪去,现对褪色原因进行探究。
提出你的假设:________________________________________________;
为了对你所提出的假设进行验证,你设计的实验方案是_____________________。
23.(5分)
(1)目前,世界上已将乙烯的产量作为衡量一个国家石油化工发展水平的标志。乙烯的结构式为____________。
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X的结构简式是____________。
(3)某有机物分子式为C3H6O2在酸性条件下水解得一元酸A与一元醇B,A与B的相对分子质量相等,则A的结构简式为____________。
(4)食品香精菠萝酯的生产路线(反应条件略去)如下:
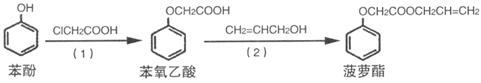
下列叙述错误的是__________
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
E.(1)的反应类型为加成反应
三、(本题包括2小题,共15分)
24.(10分)
(1)下列有关实验操作或判断正确的是_________(填有关序号,选错倒扣分)。
A.用溴水可以除去乙烯中混有的二氧化硫气体。
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出。
C.用托盘天平称取
D.测定烧杯中溶液的pH时,用pH试纸直接在烧杯中蘸取溶液。
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌。
F.实验室配制氯化Ⅱ铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
G.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
H.往溶液中加入用盐酸酸化的氯化钡溶液鉴定硫酸根离子。
I.新制氢氧化铜浊液(与醛反应):在试管中加2mL5%NaOH溶液,滴加CuSO4溶液4~5滴。
(2)下列制取干燥氨气和氯气的装置中,有错误的是_________(填仪器序号),应如何改正______________________________________________________。
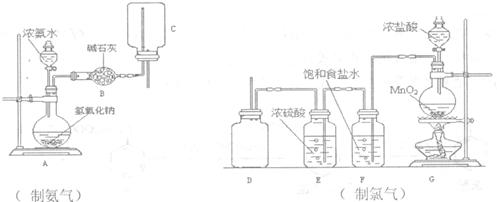
在制氨气装置中,碱石灰的作用____________________________________。
G中反应的化学方程式为__________________________________________。
25.(5分)为探究CO2与NaOH溶液发生了化学反应,甲、乙两位同学设计了下列两种实验装置,请回答下列问题。
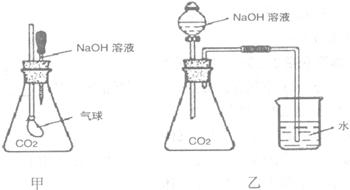
(1)请写出过量CO2与少量的NaOH发生反应的离子方程式:__________________。
(2)简述上述会出现的实验现象,解释产生该实验现象的原因。
甲:
乙:
四、(本题包括2小题,共14分)
26.(8分)有机玻璃是日常使用较多的化工产品,用下面的流程可以合成有机玻璃(聚甲基丙烯酸甲酯)
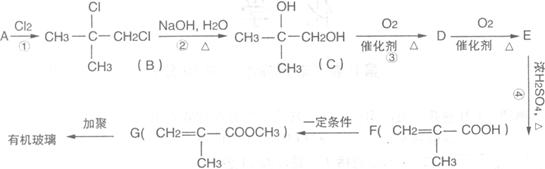
根据上述过程回答下列问题:
(1)A的名称:______________;写出E的结构简式:______________。
(2)写出上述过程中的反应类型:②______________④______________。
(3)写出③的化学方程式__________________________________________。
(4)任写一个G的属于酸的同分异构体的结构简式:_______________________。
27.(6分)
(1)将6gFe3O4加到100mL某浓度的盐酸中,再加入9.8gFe粉,反应停止时,溶液无固体存在,向溶液中滴加KSCN溶液,未见颜色变化,为了中和过量盐酸(不考虑盐酸的挥发),且使铁元素转化为Fe(OH)2,共消耗5.0mol/L NaOH溶液160mL,则原盐酸的物质的量浓度为______________。
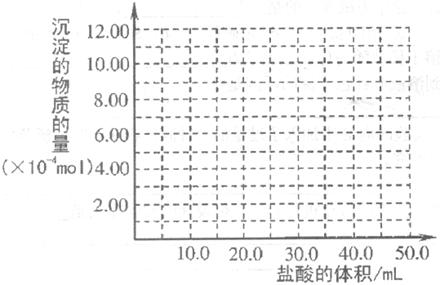
(2)将Al2O3与过量NaOH溶液充分反应,其反应的离子方程式为:______________ ____________________________。取上述充分反应后的溶液10.0mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100mol?L-1盐酸溶液,当加入50.0rnL盐酸溶液时,生成的沉淀恰好溶解。请画出生成沉淀的物质的量与加入盐酸体积的关系图。
2008-2009学年度威海市高三年级教学质量调研考试
一、选择题(本题包括20小题,1―10题每题2分,11―20题每题3分,共50分。每小题只有一个选项符合题意)
1―5 DCBBA 6―10 CBCCB 11―15 BDCAD 16―20 DAADA
二、(本题包括3小题,共21分)
21.(6分)
(1)KOH(1分)
(2)Ar K+(Ca2+、HS-、S2-、 ) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
(3) (1分)
(1分)
22.(10分)
(1)FeCl2 KSCN(或NH4SCN)溶液(2分)
(2)d(2分)
(3) (2分)
(2分)
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+增多从而使红色加深(1分)
(5)假设:加入还原剂将Fe3+还原(1分)
用胶头滴管取少量黄色褪色后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水,如果溶液开始不出现红色,加氯水后出现红色,则说明假设正确,若溶液不变红色,则假设不正确。(2分)(有其他合理假设、答案也可酌情得分)。
23.(5分)
(1) (1分)
(1分)
(2)CH3CHO(1分)
(3)HCOOH(1分)
(4)DE(2分)
三、(本题包括2小题,共15分)
24.(10分)
(1)B、E、F、I(4分,多选、漏选、错选一个扣1分,扣完为止)
(2)D(1分)制氯气的D中进气导管应深入集气瓶底,(1分)逸出的氯气应通入盛有烧碱溶液的烧杯中。(1分)
干燥氨气;(1分)
 (2分)
(2分)
25.(5分)
(1) (1分)
(1分)
(2)甲 现象:气球膨胀
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大。(2分)
乙 现象:烧杯内的水流入锥形瓶中
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将水压入锥形瓶中。(2分)
四、(本题包括2小题,共14分)
26.(8分)
(1)甲基丙烯或2―甲基丙烯  (2分,各1分)
(2分,各1分)
(2)②取代反应(或水解反应) ④消去反应(2分,各1分)
(3)(2分)

(4) (2分,其他合理写法都给分)
(2分,其他合理写法都给分)
27.(6分)
(1)8.0 mol/L(2分)(注意有效数字)
(2) (或
(或 )(2分)
)(2分)
画图(2分)
