网址:http://m.1010jiajiao.com/timu_id_170060[举报]
一、选择题(本题包括20小题,1―10题每题2分,11―20题每题3分,共50分。每小题只有一个选项符合题意)
1―5 DCBBA 6―10 CBCCB 11―15 BDCAD 16―20 DAADA
二、(本题包括3小题,共21分)
21.(6分)
(1)KOH(1分)
(2)Ar K+(Ca2+、HS-、S2-、 ) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
(3) (1分)
(1分)
22.(10分)
(1)FeCl2 KSCN(或NH4SCN)溶液(2分)
(2)d(2分)
(3) (2分)
(2分)
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+增多从而使红色加深(1分)
(5)假设:加入还原剂将Fe3+还原(1分)
用胶头滴管取少量黄色褪色后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水,如果溶液开始不出现红色,加氯水后出现红色,则说明假设正确,若溶液不变红色,则假设不正确。(2分)(有其他合理假设、答案也可酌情得分)。
23.(5分)
(1) (1分)
(1分)
(2)CH3CHO(1分)
(3)HCOOH(1分)
(4)DE(2分)
三、(本题包括2小题,共15分)
24.(10分)
(1)B、E、F、I(4分,多选、漏选、错选一个扣1分,扣完为止)
(2)D(1分)制氯气的D中进气导管应深入集气瓶底,(1分)逸出的氯气应通入盛有烧碱溶液的烧杯中。(1分)
干燥氨气;(1分)
 (2分)
(2分)
25.(5分)
(1) (1分)
(1分)
(2)甲 现象:气球膨胀
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大。(2分)
乙 现象:烧杯内的水流入锥形瓶中
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将水压入锥形瓶中。(2分)
四、(本题包括2小题,共14分)
26.(8分)
(1)甲基丙烯或2―甲基丙烯  (2分,各1分)
(2分,各1分)
(2)②取代反应(或水解反应) ④消去反应(2分,各1分)
(3)(2分)

(4) (2分,其他合理写法都给分)
(2分,其他合理写法都给分)
27.(6分)
(1)8.0 mol/L(2分)(注意有效数字)
(2) (或
(或 )(2分)
)(2分)
画图(2分)

已知下列数据:

某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5-10 min.

③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:________;写出制取乙酸乙酯的化学方程式:________.
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母).
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________.
(4)指出步骤③所观察到的现象:________;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去________(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为________(填字母).
A.P2O5
B.无水Na2SO4
C.碱石灰
D.NaOH固体
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,下图装置的主要优点有:________.

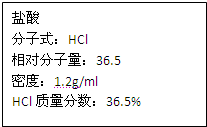 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.3mol/L稀盐酸:
(2)该学生需要量取
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)
A.用30mL蒸馏水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1-2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是
A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶.
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
| 元素 | A | B | C | D | E | F | G |
| 性 质 结 构 信 息 | 制成的高压灯,发出的黄光透雾能力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达稳定结构. | 常温常压下是气体,元素的常见化合价为-1及多种正价. | +2价阳离子核外电子数与氖原子相同. | E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同. | 常温下,其单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应. | |
(2)写出D离子的结构示意图______.
(3)写出C单质与水反应的化学方程式______.
(4)写出G与烧碱溶液反应的离子方程式______.
(5)写出F元素常见的两种同素异形体的名称______.
(6)对元素B的单质或化合物描述正确的是(填序号)______.
①B元素的最高正价为+6 ②常温常压下,其单质很难与其他物质反应
③单质分子中含有18个电子 ④其氢化物极易溶于水
(7)C、E和F 三种元素的氢化物中,沸点最高的氢化物的化学式是______;C和F 两元素的氢化物中,还原性较强的是(填名称)______.
(8)A和D 两元素金属性较强的是(填元素符号)______.写出能证明该结论的一个实验事实______.
查看习题详情和答案>>
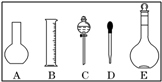 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是
(2)根据计算用托盘天平称取NaOH的质量为
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为
(4)取用任意体积的所配0.5mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(5)将所配制的稀H2SO4进行测定,发现浓度大于0.5mol/L.请你分析下列哪些操作会引起所配浓度偏大(填写字母)
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.用量筒量取浓硫酸时,仰视量筒的刻度
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.