江苏省兴化市2008―2009学年度第一学期高三年级期中调研化学试卷
可能用到的相对原子质量:H 1 C 12
N 14 O
第一卷 选择题( 共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.
A.当碳纳米与物体表面接触时,它们之间会产生许多的范德华力
B.若将碳纳米晶体用作某些反应的催化剂时,其催化效率比普通碳高
C.碳纳米晶体管用作燃料电池负极时,可燃气体在负极上发生氧化反应
D.碳纳米晶体能与浓硫酸反应生成两种气体,但不能与浓硝酸反应
2.以下说法中,符合科学规律的是( )
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使同一元素不同核素相互转化 ③改变核内质子数可使同一元素的离子间相互转化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①③ B.②④ C.①② D.①②③④
3.如下图所示,燃料在燃烧后的产物(如CO2、H2O、N2)等可以利用太阳能实现转化循环利用。则下列有关说法不正确的
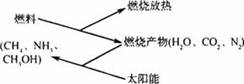
A.通过上述循环,太阳能最终转化为热能
B.所有可燃物燃烧时放出的能量均来源于太阳能
C.上述转化虽可循环,但之间的反应不属于可逆反应
D.上述转化不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机
 4.用NA表示阿伏加德罗常数的值,下列叙述正确的是
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.
B.
C.0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA
D.
5.下列有关物质用途的说法中,正确的是
A.二氧化硅可用来制造半导体材料 B.硅可用于制造光导纤维
C.氢氧化铝可用于治疗胃酸过多 D.硫酸铁净水主要利用了Fe3+的氧化性
6.在下列溶液中,各组离子一定能够大量共存的是
A.能使pH试纸变深蓝色的溶液: SO32一、K+、Na+、CO32一
B.能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3一、Cl一
C.澄清透明的无色溶液:ClO一、MnO4一、Al3+、SO42一
D.在0.1mol/L的氯化铁溶液中:Fe3+、NH4+、NO3一、OH一
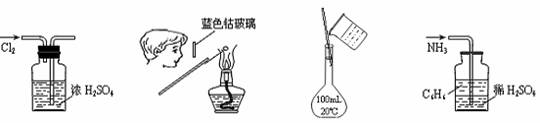 7.下列各图所示的实验原理、方法、装置和操作正确的是
7.下列各图所示的实验原理、方法、装置和操作正确的是
① ② ③ ④
A.①干燥Cl2 B.②检验K2CO3中的K+
C.③配制150 mL 0.10 mol?L-1盐酸 D.④吸收NH3
8.在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.标准状况下,将
B.常温下,向100mL 3mol/L的硝酸中加入
C.在适当温度和催化剂作用下,用2molSO2和1molO2合成SO3
D.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列关于某些物质的检验方法正确的是
A.利用Ba(OH)2鉴别Na2CO3溶液和NaHCO3溶液
B.用焰色反应鉴别NaCl、KCl和Na2SO4三种物质
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.通过向瓶中加入适量水观察溶液颜色变化证明一瓶气体是溴蒸气还是二氧化氮
10.在浓盐酸中,H3AsO3与 SnCl2反应的离子方程式为:
3SnCl2+ 12Cl-+ 2H3AsO3+6H+=2As +3 SnCl62-+
A.在反应中Sn元素被氧化, As元素被还原
B.氧化剂是SnCl2,氧化产物为SnCl62-
C.生成物M为OH-
D.每生成7.5gAs,还原剂失去0.3mol电子
11.下列离子方程式书写正确的是
A.NaHSO4溶液中滴入Ba(OH)2溶液至中性: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.将少量的硝酸银溶液滴入氨水中 Ag+ + NH3?H2O = AgOH↓ + NH4+
C.Ca(HCO3)2溶液中加入过量KOH溶液:Ca2+ + HCO3-+OH-==CaCO3↓+ H2O
D.硫酸亚铁酸性溶液中加入过氧化氢:4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
12.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生: ① IO3-+ 5I―+ 6H+ → 3I2 + 3H2O ② I2 + 2HSO3-+ H2O → 2I- + 2SO42-+ 4H+
当反应进行到15min时,溶液突然变为蓝色,随之又很快消失。这一反应被称做时钟反应,有人用它来解释生物钟现象。下列有关说法不正确的是
A.在整个反应过程中,起催化作用的物质是KI
B.上述两个反应中,反应速率较快的是②
C.时钟反应的快慢由反应②决定
D.“溶液突然变为蓝色,随之又很快消失”这一现象与①②的反应速率有关
13.在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
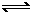
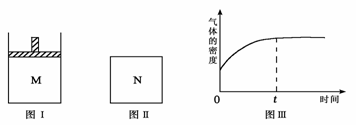 平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
14.将固体MnC2O4?2H2O放在坩锅里加热,固体质量随温度变化的数据如下表:
温度/℃
25
50
75
100
214
280
固体质量/g
17.9
17.9
16.0
14.3
14.3
7.15
下列说法不正确的是
A.25~
B.
C.
D.
第二卷(非选择题 共72分)
三、(本题包括1小题,共14分)
15.(14分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是:
。
(2)简述强调“测得的pH小于
。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色。请用离子方程式解释这一现象产生的原因:
。
由此说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:
。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
 该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
编号
盐酸
NaOH溶液
△t/℃
1
3.65?
2.00?
3.5
2
3.65?
4.00?
x
3
7.30?
8.00?
14
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。
|
 (10分)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
(10分)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题: 2NH3(g)
2NH3(g)

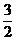 O2(g) △H1=+765.2 kJ?mol-1
O2(g) △H1=+765.2 kJ?mol-1 (2)CO32―+H2O HCO3―+OH―
(2)CO32―+H2O HCO3―+OH―

 4AlN+SiC+
4AlN+SiC+ 五、(本题包括1小题,共10分)
五、(本题包括1小题,共10分) ⑶ r(Cl-)>r(K+)
⑶ r(Cl-)>r(K+)

 六、(本题包括1小题,共10分)
六、(本题包括1小题,共10分)
 Al(OH)3
Al(OH)3