网址:http://m.1010jiajiao.com/timu_id_169124[举报]
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.D 2.C 3.B 4.D 5.C 6.A 7.B 8.D
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.CD 10.AD 11.D 12.C 13.BC 14.D
三、(本题包括1小题,共14分)
15.
方案一:
(1)在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
(2)排除因盐酸的加入,稀释氢氧化钠溶液而引起pH减小
方案二:
(1)赶走溶液中少量氧气,隔绝氧气
 (2)CO32―+H2O HCO3―+OH―
(2)CO32―+H2O HCO3―+OH―
(3)做对比实验,取上述NaOH溶液稀释,加入酚酞溶液出现红色且不褪去
方案三:
(1)7 (2)U形管中左边液面下降
(每空2分,共14分)
四、(本题包括2小题,共18分)
16.
⑴ 

⑵CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-
⑶Al4SiC4+2N2 4AlN+SiC+
4AlN+SiC+
⑷可行,该反应是一个焓减、熵略大于0的反应,能自发进行
(每空2分,共8分)
17.
⑴ CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
生成的CaCO3溶解度小于CaSO4有利于反应向正向进行。
⑵)BCD ⑶CO2 ⑷ABD(每空2分,共10分)
 五、(本题包括1小题,共10分)
五、(本题包括1小题,共10分)
18.
⑴见图示(2分 ,其中过渡元素涂对得1分)
⑵  ⑶ r(Cl-)>r(K+)
⑶ r(Cl-)>r(K+)
⑷ ②④ (5) 
(除⑴外其余每空2分,共10分)
 六、(本题包括1小题,共10分)
六、(本题包括1小题,共10分)
19.
⑴①增大压强 t3~t4 ②
⑵①如图 ②适当增大压强,研究新催化剂
(每空2分,共10分)
七、(本题包括1小题,共8分)
20.
⑴ 2 第2周期第VIA族 (各1分,共2分)
⑵1s22s22p63s23p63d64s2
⑶H+ + AlO2-
+ H2O Al(OH)3
Al(OH)3 Al3+ + 3H2O
Al3+ + 3H2O
⑷4Fe(OH)2 + 2H2O+ O2=4Fe(OH)3
(除⑴外其余每空2分,共8分)
八、(本题包括1小题,共12分)
21.
⑴-80kJ?mol―1
⑵用过量的稀硫酸溶解过量的镁,不断搅拌,过滤,洗净、干燥
⑶加快反应速率,促进平衡向水解的方向移动
⑷取少量洗涤液,在其中加入AgNO3(或BaCl2),无沉淀生成则说明无相应离子。
Ag++Cl-=AgCl↓ Ba2++SO42-=BaSO4↓
(每空2分,共8分)
Ⅲ 1.5mol/L(4分,分步给分)
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)写出该反应的化学方程式
| ||
| ||
(2)请在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注
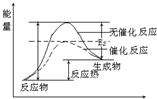

(3)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议:
(4)已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
①计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H=
②室温下NH3就和HCl能发生化合反应生成NH4Cl;而在加热的条件下,NH4Cl则能分解为NH3和HCl.请用所学的化学原理解释这一现象:
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
(1)该反应在较低温度下能否自发进行?
(2)从323K到353K,氨气的生成量减少的原因
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
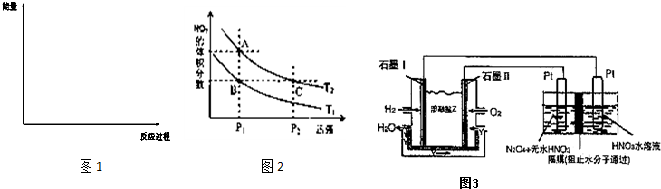
(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
| 4 |
| 7 |
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) ΔH=+765.2 kJ·mol-1
O2(g) ΔH=+765.2 kJ·mol-1
回答下列问题:
(1)请在答题卡的坐标图中,画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为
2NH3(g)。设在容积为![]() 。计算
。计算
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
![]() N2(g)+3H2O(l) 2NH3(g)+
N2(g)+3H2O(l) 2NH3(g)+![]() O2(g)
O2(g)
ΔH=+765.2 kJ·mol-1
回答下列问题:![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
![]() (3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入
0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 。计算:
。计算:
①该条件下N2的平衡转化率;
![]() ②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。
(8分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)====2NH3(g)+O2(g) ΔH=+765.2kJ·mol-1
回答下列问题:
(1)右图是上述反应在无催化剂情况下反应过程中体系能量变化示意图,请在图中画出在有催化剂情况下反应过程中体系能量变化示意图。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)工业合成氨的反应为N2(g)+3H2(g)2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
。计算
①该条件下N2的平衡转化率是 ;
②该条件下反应2NH3(g)N2(g)+3H2(g)的平衡常数为 。
③若温度不变,减小容器体积,则平衡向---------------------------移动,c(NH3)将--------------------
c(N2)将---------------------- (填增大、减小或不变)
查看习题详情和答案>>