2009高三化学周考测试题
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共100分,考试时间100分钟.
第Ⅰ卷(选择题 共60分)
可能用到的相对原子质量:H―
Cl―35.5 Cu―64
一.单项选择题(本题有20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1.化学与材料科学息息相关,从一定意义上讲,材料是科学技术的先导,没有新材料的发展,就不可能使新的科学技术成为生产力。下列有关材料的说法不正确的是 ( )
A.材料是为人类社会所需要并能用于制造有用器物的物质。
B.人类使用和制造材料有悠久的历史,制造出的第一种材料是陶。
C.高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜。
D.体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后可以制成其它形状的器物。
2.下列反应中,既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应
B.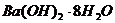 与
与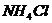 的反应
的反应
C.灼热的炭与二氧化碳的反应 D.硫酸氢钠与氢氧化钡的反应
3.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子。若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A.CH3COO- B.SO32- C.CO32- D.HCO3-
4.将pH=3的强酸溶液和pH=12的强碱溶液相混合,当混合溶液的pH等于11时,强酸与 强碱溶液的体积比是
A.9∶2 B.9∶
5.在100mL某混合溶液中,c(HNO3)=0.4mol•L-1;c(H2SO4)=0.1mol•L-1。向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu2+)为 ( )
A.0.15mol•L-1 B.0.3mol•L-
6.在容积固定的密闭容器中,对于反应:2SO2(g)+O2(g)
 2SO3(g);△H<0。下列判断正确的是 ( )
2SO3(g);△H<0。下列判断正确的是 ( )
A.增大反应体系的压强,反应物活化分子百分数增加
B.当单位时间内消耗SO2的物质的量和生成SO3的物质的量相同时,反应达到平衡状态
C.升高温度,平衡向左移动
D.充入SO3气体,体系压强增大,平衡向右移动
7.下列离子方程式书写正确的是 ( )
A.在含n mol FeBr2的溶液中通入n molCl2
2Fe2+ + 2Br― + 2Cl2 === 2Fe3+ + Br2 + 4Cl―
B.用氨水吸收少量的SO2
NH3•H2O + SO2 === NH4+ + HSO3―
C.在Ca(HCO3)2溶液中加入含等物质的量NaOH的溶液
Ca2+ + 2HCO3―+2OH― === CaCO3↓+ CO32― + 2H2O
D.将少量SO2通入NaClO溶液中
SO2+2ClO―+H2O===SO32―+2HClO
8.用N0表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.在反应CaO+
B.常温时,
C.1mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为N0
D.1molNH2―中含电子数为10 N0
9.用物质的量都是0.1 mol的HCN和NaCN配成
A.c(Na+)>c(CN-)>c(H+)>c(OH-) B.c(CN-)+c(HCN)=0.2 mol?L-1
C.c(CN-)+c(OH-)=0.1 mol?L-1 D.c(Na+)+c(H+)=c(CN-)
10、向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出
A.0.24 mol B.0.21mol C.0.16 mol D.0.14 mol
11.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
 ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
12.下列中学常见实验的现象或表述正确的是
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
C.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
D.向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会,然后冷却、过滤,滤纸上的物质为“蓝色固体”。
13.常温下,下列溶液中一定能大量共存的离子组是
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
14.含有2~5个碳原子的直链烷烃沸点和燃烧热的数据见下表:
烷烃名称
乙烷
丙烷
丁烷
戊烷
沸点(℃)
-88.6
-42.1
-0.5
36.1
燃烧热(kJ?mol-1)
1560.7
2219.2
2877.6
3535.6
根据表中数据,下列判断错误的是( )
A.正庚烷在常温常压下肯定不是气体
B.烷烃燃烧热和其所含碳原子数成线性关系
C.随碳原子数增加,烷烃沸点逐渐升高
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
15.在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是
A.氧化性:ClO ?>I2>SO42?
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D. 次氯酸钠可以与亚硫酸钠共存
16.用右图表示的一些物质或概念间的从属关系中不正确的是
X
Y
 Z
Z
例
氧化物
化合物
纯净物
A
苯的同系物
芳香烃
芳香族化合物
B
胶体
分散系
混合物
C
电解质
离子化合物
化合物
D
碱性氧化物
金属氧化物
氧化物
17.从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第④步电解时阴极产生氯气
18.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同;两者互为同分异构体
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
C.P4、CH4、NH4+粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
D.Ca2+的结构示意图为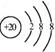 ,NH4Cl的电子式为
,NH4Cl的电子式为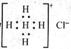
19、室温下,某强酸溶液pH = a,某强碱溶液pH = b,已知a
+ b = 12,且两溶液混合后溶液pH = 7。则该强酸溶液的体积V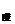 与强碱溶液的体积V
与强碱溶液的体积V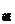 的正确关系为
的正确关系为
A.V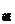 = 102 V
= 102 V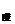 B.V
B.V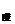 = 102V
= 102V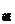 C.V
C.V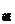 =2V
=2V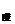 D.V
D.V =2 V
=2 V
20.硝酸铵(NH4NO3)在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是
A.N2O、H2O B.N2、O2、H2O
C.N2、HNO3、H2O D.NH3、NO、H2
2007高三化学周考测试题
第Ⅱ卷(非选择题,共40分)
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
二、填空题(12分)
21.(12分)A、B、C是中学化学中常见的三种短周期元素。已知①A元素原子最外层电子数是次外层电子数的2倍。②B元素最高正价与负价的代数和为2。③C元素有多种化合价,且常温下C元素的单质与某种一元碱溶液反应,可得到两种含C元素的化合物。④B、C两种元素质子数之和是A元素质子数的4倍。
( 1 ) 写出A、B、C三种元素的名称:A B C
( 2 ) 写出C的单质和强碱溶液反应的离子方程式 。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的分子式 。分子中B、C原子间的化学键的类型为 。(填“极性键”或“非极性键”)X与水反应的化学方程式 。
(4)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为 , Y的硬度比金刚石硬度大的原因是 。
三、实验题(18分)
22.(12分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3 ;
NH4HCO3+NaCl NaHCO3↓+NH4Cl ;
 2NaHCO3 Na2CO3+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
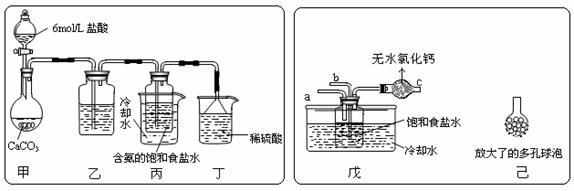
试回答下列有关问题:
 (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称)。
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: 。
四、推断题
23.(8分)下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水,也难溶于稀酸的白色固体。
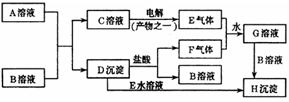
⑴写出化学式:A_________;B_________。
⑵写出下列反应的离子方程式:
①D→H:______________ ____ ;
②E+F+H2O→G:______ _____ 。
24.(8分)以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
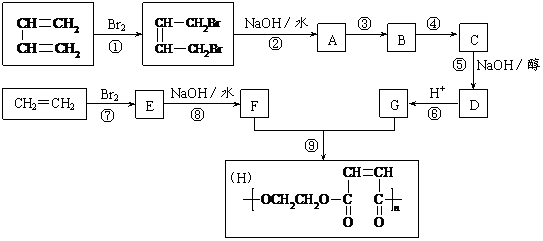
请按要求填空:
⑴写出下列反应的反应类型:
反应①________________,反应⑤________________,反应⑧________________。
⑵反应②的化学方程式是__________________________________________。
一、选择题
1D,
二、填空题
21.(12分)
(1)A:碳 B:氮 C:氯 (各1分)
(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)NCl3 (1分)极性键(1分) NCl3+ 3H2O=NH3+3HClO (2分)
(4)C3N4 (1分)因为N的原子半径比C的原子半径小,键长更短,所以C3N4的硬度比金刚石硬度大。(2分)
三、实验题
22.(12分) (1)c (1分)
(2)①(Ⅰ)饱和碳酸氢钠溶液; (Ⅱ)吸收未反应的NH3(答“防止倒吸”或“吸收CO2”不给分));
(Ⅲ)过滤 (每空1分,共3分)
②(Ⅰ)a、NH3, b、CO2; (每空1分,共4分)
(Ⅱ)增大气体与溶液接触面积,提高CO2吸收率; (2分)
(3)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2 ;往饱和Na2CO3 溶液中通入过量CO2 等。其他合理方法均可) (2分)
四、推断题
|
 +2NaOH→
+2NaOH→ +2NaBr (2分)
+2NaBr (2分) (5分)
(5分)