皖东十校高三第二次模拟考试理科综合
(满分300分,考试时间150分钟)
以下数据可供解题时参考:
相对原子质量(原子量):H―1 0―
第Ⅰ卷(选择题 共126分)
一、选择题(本题包括13小题。每小题只有一个选项符合题意,每题6分)
1.对实验狗的下丘脑进行直接加温,引起狗的气喘、血管舒张和产热抑制等反应,而冷却其下丘脑,又会引起寒战、血管收缩等反应。下列与解释该现象有关的是( )
①下丘脑存在着温度感受器 ②下丘脑存在着温度调节的效应器 ③下丘脑存在着温度调节中枢
A.③ B.①③ C.②③ D.①②③
答案:B 【解析】由题干看出下丘脑直接感受温度变化并支配血管等做出相应反应,既是感受器又是神经中枢,血管等是效应器。
2.下图为果蝇某一条染色体DNA上的几个基因分布示意图(图中ABCD代表四个基因),下列是与此图有关的叙述,其中正确的有( )

①每个基因都是由成百上千个核糖核苷酸组成的
②每个基因中有一个碱基对的替换,都会引起密码子的改变
③A、B、C、D四个基因都表示的是编码区,不包括非编码区
④假设C中含有a个碱基,由它转录的mRNA应有碱基a/2个
⑤A基因编码区是连续的,没有外显子和内含子之分
⑥如果B基因是要提取目的基因,欲将其导入大肠杆菌体内,可采用限制酶直接切取来获得
A.3个 B.2个 C.1个 D.0个
答案:D 【解析】DNA的基本组成单位是脱氧核苷酸。
果蝇是真核生物,其基因的编码区是不连续的,有外显子和内含子,提取其基因时多采用人工合成法(逆转录法、化学合成法),在转录形成的成熟的mRNA中只有外显子对应的碱基序列。
3.下列关于细胞工程的叙述中,不正确的是( )
A.植物细胞工程中,叶肉细胞经再分化过程可形成愈伤组织
B.克隆羊“多莉”的培育技术主要包括核移植和胚胎移植两方面
C.植物细胞工程中,融合叶肉细胞时,应先去掉细胞壁,制备原生质体
D.单克隆抗体制备过程中,采用经免疫的B淋巴细胞与骨髓瘤细胞融合从而获得杂交瘤细胞
答案:A 【解析】离体的植物细胞、组织、器官在适宜条件下经脱分化形成愈伤组织,经再分化形成具备生根发芽能力的胚状体,经营养、生殖生长形成植株,此为
4.某植物种子在适宜条件下鲜重的变化情况如下图所示,A表示萌发的种子,B表示休眠或死亡的种子。据图判断,种子萌发时鲜重发生的变化情况是( )
A.在第Ⅰ阶段显著增加,第Ⅱ阶段相对不变
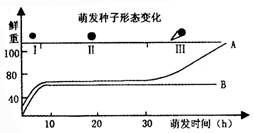
B.在第Ⅰ、Ⅱ阶段显著减少,第Ⅲ阶段显著增加
C.在第Ⅰ、Ⅱ阶段变化很小,第Ⅲ阶段显著减少
D.在第Ⅰ、Ⅱ阶段显著增加,第Ⅲ阶段变化很小
答案:C 【解析】在种子萌发的Ⅰ、Ⅱ阶段以吸胀吸水为主,细胞鲜重增幅较小,自由水较少,代谢较弱,有机物分解少,在第Ⅲ阶段,细胞鲜重增幅较大,自由水增多,代谢加强,有机物利用加快、增多。
5.流行性感冒是“流感病毒”引起的,在该病毒流行时,要预防“流感”每天都要开一会窗,保持室内空气清新;植树造林时选用多个树种;大棚生产蔬菜时要保持昼夜温差。以上这些从生态学角度来看分别是( )
①降低种群密度 ②调整生物群落结构 ③调整非生物因素 ④改变生态系统成分
A.④②④ B.①③② C.③②③ D.①②③
答案:D 【解析】通风换气可以减少室内空气中流感病毒的数量,多个树种混合种植使生物群落的结构更加复杂,生态系统更加稳定。温度是影响生物的生态因素之一。
6.核裂变产生的核能可用于发电,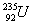 是一种常用的核燃料,下列有关说法错误的是( )
是一种常用的核燃料,下列有关说法错误的是( )
A.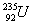 与
与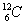 的质量比约为235:12 B.
的质量比约为235:12 B.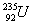 中中子数比质子数多51
中中子数比质子数多51
C.U元素的近似相对原子质量为235 D.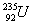 与
与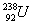 属于同一种元素
属于同一种元素
答案:C 【解析】本题是对原子结构知识的考查。本题应把握几个定义:质量数=中子数+质子数;同位素是指质子数相同中子数不同的原子,但属于同一种元素。C项中质量数决不同于相对原子质量,也不同于近似相对原子质量,所以C项错。
7.在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的( )
A.原子数 B.分子数 C.质量 D.密度
答案:B 【解析】本题是对原子数,分子数,质量等关系的考查。NH3是4原子分子,N2和H2是双原子分子。相同体积的NH,与N2和H2的混合气体原子数不同,体积相同即物质的量相同,所以分子数相同,所以B正确,两容器中气体的质量不一定相等,所以密度也不同。上易考网络(www.ekaonet.com)下最新高考资料
8.设NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+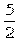 O2
(g)→2CO2 (g)+ H2O (g);ΔH=-1 300 kJ?mol-1的说法中正确的是( )
O2
(g)→2CO2 (g)+ H2O (g);ΔH=-1 300 kJ?mol-1的说法中正确的是( )
A.有10 NA个电子转移时,吸收1 300 kJ的热量
B.有NA个水分子生成且为液态时,放出1 300 kJ的热量
C.有NA对碳氧共用电子对生成时,放出1 300 kJ的热量
D.有8 NA对碳氧共用电子对生成,且水为气态时,放出1 300 kJ的热量
答案:D 【解析】本题是对阿伏加德罗常数和热化学方程式的考查。A项中AH<0应为放热反应,所以A项错。题目中放出1 300 kJ热量时,水为气态,当水为液态时放出的热量应大于1 300kJ,所以B错;一个CO2分子中有4对碳氧共用电子对,当生成8对共用电子对时放出的热量是1 300 kJ,所以C项错,D正确。
9.在体积可变的密闭容器中进行可逆反应:2SO2
(g)+O2 (g)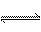 2SO3(g);ΔH<0并在一定温度下达到平衡。现改变某一条件,可以使正、逆反应速率均在改变条件的瞬间减小,并导致化学平衡向逆反应方向移动的是( )
2SO3(g);ΔH<0并在一定温度下达到平衡。现改变某一条件,可以使正、逆反应速率均在改变条件的瞬间减小,并导致化学平衡向逆反应方向移动的是( )
A.降低温度 B.保持体积不变充入一定量N2
C.保持压强不变,充入一定量Ar D.保持体积不变,充入SO3
答案:C 【解析】本题是对化学平衡移动的考查。A项中降低温度,正逆反应速率都减小,但平衡向放热方向移动,即向正向移动,所以A错;B项中在体积不变的情况下充入氮气,因反应物和生成物浓度不变,所以反应速率不变;C项冲压强不变,充入氩气,使体系的体积增大,从而使反应物和生成物浓度减小,反应速率减小,减压平衡向体积增大的方向移动,即逆向移动,所以C正确;D项体积不变,充入SO3,相当于增大了生成物的浓度,此时逆向反应速率增大,所以D错。
10.下列叙述正确的是( )
A.由多种非金属元素组成的化合物一定是共价化合物
B.含有金属元素的化合物一定是离子化合物
C.晶体熔化时化学键不一定断裂
D.晶体中只要有阳离子就一定有阴离子
答案:C 【解析】本题是对有关化学键知识的考查。NH4Cl是由非金属元素组成的化合物,但它是离子化合物,所以A错;AlCl3中含有金属元素,但它是共价化合物,所以B错;分子晶体融化时,化学键不断裂,所以C正确;在金属晶体中只有阳离子和电子而没有阴离子,所以D错。
11.在
A.13 B.14 C.15 D.无法计算
答案:A 【解析】本题考查的是酸碱中和与pH的计算。根据题意可知盐酸和氢氧化钠恰好中和,根据n(H+)=ri(OH-)可计算出x+y=13,所以A正确。
12.相同物质的量浓度的下列化合物的水溶液,按pH减小顺序排列的是( )
A.NaHSO4、NH4Cl、NaNO3、CH3COONa
B.NaHCO3、C6H5ONa、Na2CO3、CH3COONa
C.CH3COONa、NaNO3、(NH4)2SO4、NH4NO3
D.Na2CO3、NaHCO3、NH4Cl、NaHSO4
答案:D 【解析】本题考查的是弱离子水解程度的大小对溶液酸碱性的影响。一般规律:弱阳离子对应的碱的碱性越弱,水解程度就越大,则溶液的酸性就越强,相同的弱阳离子,浓度越大,对应的溶液的酸性就越强;同理弱阴离子对应的酸的酸性越弱,水解程度就越大,则溶液的碱性就强,相同的弱阴离子,浓度越大,对应的溶液的碱性就越强。而硫酸氢钠是强酸的酸式盐,能完全电离出H+,所以应该显酸性。根据上述规律可知答案是D。
13.MCFC型燃料电池可同时供应电和水蒸汽,其工作温度为
A.该电池的正极反应式为:4
B.该电池负极反应式为:H2+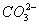 -2e-====CO2+H2O
-2e-====CO2+H2O
C.当电路中通过a mol电子时,则该电池理论上可供应
D.放电时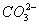 向正极移动
向正极移动
答案:B 【解析】本题是对燃料电池的考查。A项中正极反应应是2H2O+O2+4e-====4OH-;C项生成1 mol水需要2 mol电子,所以转移d mol电子生成(J/2 mol水,即9d g水;D项负极H2失电子生成H+,和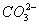 反应,所以
反应,所以 向负极移动。
向负极移动。
二、选择题(本题包括8小题。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)
14.下列说法正确的是( )
A.竖直放置的铁丝框中的肥皂膜,在太阳光的照射下形成彩色水平干涉条纹
B.面积较大的光源使物体在光屏上的影子模糊不清,是光的衍射现象
C.凸透镜把阳光会聚成边缘带彩色的光斑,“彩色边缘”是光的干涉现象
D.照相机镜头在阳光下看上去呈淡紫色,是光的干涉现象
答案:AD 【解析】肥皂膜在阳光下的彩纹和照相机镜头呈现淡紫色,都属于薄膜干涉;而面积比较大的光源照射物体时,影子边缘模糊不清楚,这是由于光的半影所致;凸透镜把太阳光会聚成边缘带彩色的光斑,这是由于光的色散,根据以上分析可知正确答案是AD。该题考查光学规律,涉及知识点多。
15.下列说法正确的是( )
A.质量相同的物体内能一定相等
B.气体吸收热量,内能不一定增加
C.热量只能自发的从内能多的物体向内能少的物体传递
D.热量不可能从低温物体向高温物体传递
答案:B 【解析】物体的内能是所有分子的动能和势能的总和,改变物体的内能有两种方式,一是热传递,二是做功,再根据热学第二定律可以判断正确答案是B。该题考查热学中内能的有关规律,属容易题目。
16.下列说法正确的是( )
A.当氢原子从n=1的状态跃迁到n=3的状态的,发射出光子
B.放射性元素的半衰期是指大量该元素的原子核中有半数发生衰变需要的时间
C.某一元素的多种同位素都具有相同的核电荷数
D.中子与质子结合成氘核时吸收能量
答案:BC 【解析】氢原子从低能级向高能级跃迁时要吸收能量,A错误;中子与质子结合成氘核时属于聚变,要放出大量的能量,D错误;根据半衰期和同位素的概念可以判断BC正确。该题考查近代物理中的有关概念,属容易题目。
17.如图所示,两个直角三棱镜Ⅰ、Ⅱ是用同种玻璃制成的。Ⅰ的顶角略大于Ⅱ的顶角。两束单色光A、B分别垂直棱镜Ⅰ、Ⅱ的表面入射,然后从另一个侧面射出。两条折射光线与第二个侧面的夹角相同。则下列说法正确的是( )
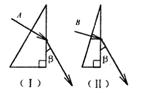
A.A光线在玻璃中的速度比B光线的在同种玻璃中的速度大
B.在真空中A的波长比B的波长长
C.A光线在玻璃中比B光线在同种玻璃中更容易发生全反射
D.若A光线能使某种金属产生光电效应,则B也一定能使这种金属产生光电效应
答案:ABD 【解析】首先判断两束光的入射角即玻璃棱镜的顶角,∠1>∠2,根据折射定律n=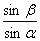 ,可得nA<nB,所以fA<fB,由此判断正确答案是ABD。该题考查光学的有关规律,能够分析出两束光频率的大小关系是解决问题的关键。
,可得nA<nB,所以fA<fB,由此判断正确答案是ABD。该题考查光学的有关规律,能够分析出两束光频率的大小关系是解决问题的关键。
18.如图所示是一列简谐波在t=0时刻的波形图。质点c在t=3秒时第一次到达波峰,此时质点e点恰好在平衡位置且向下运动。则下列说法正确的是( )
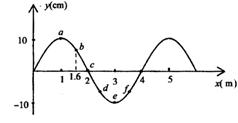
A.t=0时质点d向上运动
B.这列波的波速为
C.这列波的波速为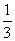 m/s,频率为
m/s,频率为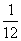 Hz
Hz
D.t=0.4 s时,b质点恰好回到平衡位置
答案:BD 【解析】根据e点在3s时第一次在平衡位置,且向下运动,可以判断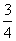 T=3s,T=4s,而且t=0时刻向下振动,所以该波波速v=
T=3s,T=4s,而且t=0时刻向下振动,所以该波波速v=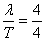 m/s=
m/s=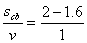 s=0.4 s,所以正确答案是BD。该题考查振动和波的有关规律。
s=0.4 s,所以正确答案是BD。该题考查振动和波的有关规律。
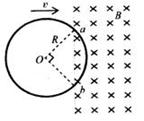
19.如图所示,均匀导线制成的、半径为R的圆环。以v的速度匀速进入一磁感应强度大小为B的匀强磁场。当圆环运动到图示位置(∠aOb=90°)时,a、b两点的电势差为( )
A.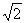 BRv B.
BRv B.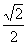 BRv C.
BRv C.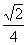 BRv D.
BRv D.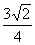 BRv
BRv
答案:D 【解析】整个圆环电阻是R,其外电阻是圆环的3/4,即磁场外的部分,而磁场内切割磁感线的有效长度是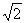 R,其相当于电源,c=B?
R,其相当于电源,c=B?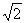 R?v,根据欧姆定律可得正确答案D。该题考查电磁感应的有关规律,注意题目问的电势差不是电动势,粗心容易误选A。
R?v,根据欧姆定律可得正确答案D。该题考查电磁感应的有关规律,注意题目问的电势差不是电动势,粗心容易误选A。
20.如图(甲)所示,一电子以v0的初速度沿平行金属板的轴线射入金属板空间。从电子射入的时刻开始在金属板间加如图(乙)所示的交变电压,假设电子能穿过平行金属板。则下列说法正确的是( )
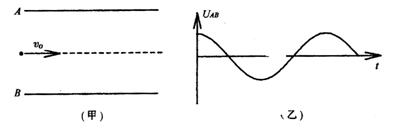
A.电子只可能从轴线到上极板之间的空间射出(不包括轴线)
B.电子只可能从轴线到下极板之间的空间射出(不包括轴线)
C.电子可能从轴线到上极板之间的空间射出,也可能沿轴线方向射出
D.电子射出后动能一定增大
答案:C 【解析】将电子的运动分解为两个方向,水平方向匀速运动,竖直方向受到变化的电场力作用,根据对称性可以判断电子在竖直方向不会运动到轴线以下,正确答案是C,该题考查带电粒子在电场中的运动,注意是变化的电场。
21.如图所示,质量为0.

A.5 kgm/s B.6 kgm/s
C.7 kgm/s
D.8 kgm/s
答案:C 【解析】小球做平抛运动,水平和竖直方向分别列方程y=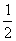 gt2,x=v0t,y=xtg30°,vy=gt=2v0tg30°,所以vt=
gt2,x=v0t,y=xtg30°,vy=gt=2v0tg30°,所以vt=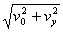 ,p=mv=
,p=mv=
第Ⅱ卷(非选择题 共174分)
三、非选择题
22.(17分)
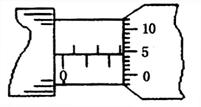
(1)测一金属丝直径时,螺旋测微器的示数如图所示,可知该金属丝的直径为__________mm。
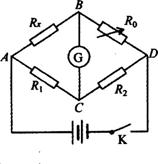
(2)如图所示的电路叫惠斯通电桥,利用它可以更加精确的测量电阻。Rx为待测电阻,R1、R2是两个阻值已知的定值电阻,R0是电阻箱。G是灵敏电流计。具体操作步骤如下:
①按电路图连接电路;
②闭合电键K,调节R0,使灵敏电流计读数为零,记下R0的读数;
③将R0代入:Rx=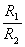 R0。计算出Rx的结果。
R0。计算出Rx的结果。
1)试用你所学过的知识证明:Rx=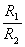 R0;
R0;
2)假如R1、R2阻值未知,在不添加和更换任何电路元件的前提下,能否测出Rx?如果能,请说明具体做法并推导出相应的计算式。
答案:(1)2.545 (5分) (2)1)证:设流过Rx、R1的支路电流分别为I1、I2,由于电流计没有电流流过,即UB=UC所以流过R0、R2的电流也分别为I1、I2,则有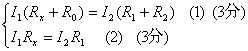
得I1
R0=I2R2代入②整理得Rx?R2= R0 R1∴Rx=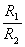 R0
(2分) 2)方法:将R1、R2位置互换,按题干操作步骤测量两次。掉换前R0读数为R01,掉换后R0读数为R02,根据上述结果得:RxR2=
R1 R01 Rx R1=R2R02整理得Rx=
R0
(2分) 2)方法:将R1、R2位置互换,按题干操作步骤测量两次。掉换前R0读数为R01,掉换后R0读数为R02,根据上述结果得:RxR2=
R1 R01 Rx R1=R2R02整理得Rx=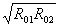 (4分)
(4分)
23.(16分)如图所示,带电量为+q的、质量为m的带电小球,处在竖直向下的匀强磁场中,磁感应强度大小为E。小球从距地面高H处由静止开始释放,小球在运动过程中受到大小恒定的空气阻力f的作用。小球与地面碰撞没有能量和电量的损失。
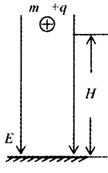
(1)求:小球与地面碰撞第n次后弹起的高度hn;
(2)求:小球释放后通过的总路程。
答案:(1)解:设第n次与地面碰撞弹起的高度为hn,根据题意,由能量守恒第1次与地面碰撞
(mg+Eq)(H-h1)=f(H+h1) ① (4分)
h1=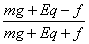 ?H第2次与地面碰撞(mg+Eq)(h1-h2)=f(h1+h2)
② (4分)
h2=
?H第2次与地面碰撞(mg+Eq)(h1-h2)=f(h1+h2)
② (4分)
h2=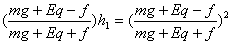 H ∴第n次与地面碰h2=
H ∴第n次与地面碰h2=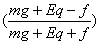 ?H ③ (2分)
(2)由能量守恒得(mg+Eq)H=fS路 ④ (4分)
?H ③ (2分)
(2)由能量守恒得(mg+Eq)H=fS路 ④ (4分)
∴S路=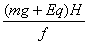 (2分)
(2分)
24.(19分)由于受地球盛行风带的影响,海水在海洋表层形成了常年稳定的定向流动叫洋流。洋流中蕴藏着巨大的动力资源。据统计,世界大洋中所有洋流的发电能力达109 kW。早在19世纪法拉第就曾设想,利用磁场使洋流发电。因为海水中含有大量的带电离子,这些离子随洋流做定向运动,如果有足够强的磁场能使这些带电离子向相反方向偏转,便有可能发出电来。
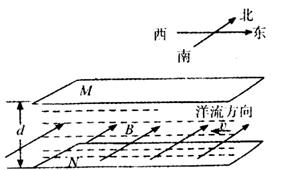
如图为洋流发电机的原理示意图,上、下两块金属板MN水平放置浸没在海水里,金属板面积均为S=1.0×
(1)由金属板和海水流动所构成的电源的电动势E及其内电阻r各为多少?
(2)若用此发电装置给一电阻为20Ω的航标灯供电,则在8h内航标灯所消耗的电能为多少?
解:(1)E=BLV ① (4分)=0.1×100×5=50V
(2分)r=ρ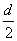 ②(4分)
r=0.25
②(4分)
r=0.25 =0.025Ω (2分)
(2)W=
=0.025Ω (2分)
(2)W=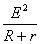 ?t ③ (4分)
?t ③ (4分)
W=3.6×106 (3分)
25.(20分)据报道:我国计划在将要发射的“神舟”七号宇宙飞船上实现太空行走。宇航员在太空行走的“交通工具”就是身上背着的贮氧筒,贮氧筒中装有一定质量的氧气并可以一定的速度喷出。当宇航员准备返回时,必须向与返回飞船相反的方向释放氧气,才能回到飞船上,同时又必须保留一部分氧气供他在返回的途中呼吸。一个连同装备共
解:设宇航员开始返回时向外释放Δm的氧气,喷气速度为u,宇航员获得的速度为v,根据动量守恒定律,且考虑Δm远远小于宇航员连同装备的总质量。
得Δmu=mv ① (4分) ∴v=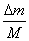 u宇航员飞回太空船的时间t=
u宇航员飞回太空船的时间t=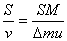 ② (4分) 此过程宇航员需要耗氧m′=2.5×10-4?t ③ (4分)
② (4分) 此过程宇航员需要耗氧m′=2.5×10-4?t ③ (4分)
=2.5×10-4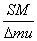 由m′+Δm=m ④ (4分)
由m′+Δm=m ④ (4分)
2.5×10-4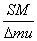 +Δm=m代入数据整理得Δm-0.5Δm+0.0225=0解得:m1=0.
+Δm=m代入数据整理得Δm-0.5Δm+0.0225=0解得:m1=0.
26.(15分)
Ⅰ:有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、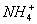 ,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如下图所示,请回答:
,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如下图所示,请回答:
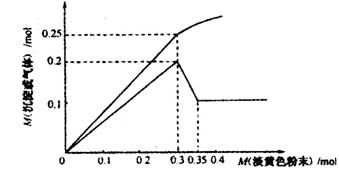
(1)溶液中肯定没有__________离子。
(2)溶液中离子的物质的量之比为__________。
(3)沉淀部分减少时的离子方程式为__________。
Ⅱ:亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:

(1)完成该反应的化学方程式并配平(未知物化学式,各物质系数填入框内)
(2)其中氧化剂是__________,若反应中有5 mol电子转移,则生成的碘是__________mol。
答案: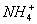 :Al3+=1:1:1
(3分)
:Al3+=1:1:1
(3分)
(3)Al(OH)3+OH-==== +2H2O
(3分) Ⅱ.(1)5,2,1,5,1,1,1;H2O (配平2分,H2O 1分) (2)KIO3
(1分);0.5
(2分)
+2H2O
(3分) Ⅱ.(1)5,2,1,5,1,1,1;H2O (配平2分,H2O 1分) (2)KIO3
(1分);0.5
(2分)
27.(15分)A、B、C、D、E、F是中学化学中常见的6种物质,它们在一定条件下可发生如下反应:
①A+B→C+D ②B+E→D+F ③C+E→A+F
(1)若A、D、E为卤素单质,反应①,②,③均为在水溶液中进行的置换反应,则A、D、E的氧化性由强到弱的顺序为__________,其中E的化学式为__________。
(2)若A、D、E是单质,C是有磁性的固体,F是无色、无味、有毒的气体,则A在周期表中的位置是__________,A和B反应的化学方程式是__________,B和E反应的化学方程式是__________。
(3)若B为淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应③的离子方程式为__________,在反应②中,若转移的电子数目为1 mol,则生成的D在标准状况下的体积为__________L。
答案:(1)E、A、D (2分) Cl2
(2分) (2)(每空2分) 第四周期第Ⅷ族;3Fe+4H2O (g)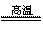 Fe3O4+4H2↑ C+H2O
Fe3O4+4H2↑ C+H2O CO+H2
(3)2OH-+CO2====
CO+H2
(3)2OH-+CO2====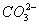 +H2O
(2分);11.
+H2O
(2分);11.
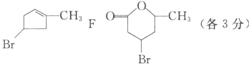
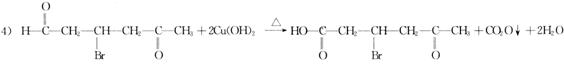
28.(15分)某研究人员发现一个破裂的小瓶中渗漏出一未知有机物A,有催泪作用。经分析A的相对分子质量为161,该化合物中除含有C、H元素外还含有一种卤族元素,且分子中含有一个甲基。
化合物A―F的转化关系如图所示,其中1 molC与足量的新制Cu(OH)2溶液反应可生成1 mol D和1 molCu2O,B1和B2均为较稳定的化合物且互为同分异构体。

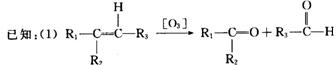
(2)一个碳原子链上有两个碳碳双键的结构不稳定(如―C====C====C―)
请回答下列问题:
1)化合物A含有的官能团有___________,B1的相对分子质量为__________。
2)①②③的反应类型分别为__________,__________,__________。
3)写出A和F的结构简式A__________,F__________。
4)写出C―D反应的化学方程式:____________________________________。
答案:1)“C=C”“―Br'’(2分);80 (1分) 2)消去、加成、取代(酯化)各(1分) 3)A
29.(15分)氧化二氯是棕黄色刺激性气体,熔点:
(1)A中盛有的固体深色试剂a是__________,分液漏斗中试剂b是__________。
(2)B中盛有液体c是__________,C中的液体d是__________。
(3)D中所发生反应的化学方程式是__________。
(4)E中的保温瓶中盛有致冷剂,它应是__________(在“干冰”“冰水”“液态空气”中选择)在E的内管得到的氧化二氯中可能含有的杂质是__________。
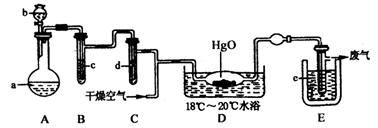
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是__________,用这些不同的连接方式的主要理由是__________。
答案:(1)KMnO4;浓盐酸 (各2分) (2)饱和NaCl溶液;浓H2SO4 (各1分) (3)2Cl2+2HgO====Cl2O↑+HgO?HgCl2 (2分) (4)液态空气;氯气(Cl2)(各2分) (5)A、B、C间可用橡胶管连接而D、E间不行 (2分) Cl2O接触有机物可能爆炸 (1分)
30.(22分)
(1)(12分)陆生植物光合作用所需的碳源,主要是空气中的CO2,CO2主要是通过叶片气孔进入叶内。有人提出陆生植物也能通过根部获得碳源,且用于光合作用?请以正常生长的菜豆幼苗为实验材料采用同位素示踪法设计一个实验,证明植物可通过根部获得碳源。
实验的主要用具有锥形瓶。你所选用的培养液中除了可含有植物所必需的矿质营养外,你认为根据实验的需要还应加入何种物质:__________。
实验步骤:
①__________________________________________________。
②__________________________________________________。
③__________________________________________________。
预测实验结果并作出解释:
_______________________________________________________________________________。
(2)(10分)自然界中植物的多倍体是因为环境条件的剧烈变化引起的,某研究性学习小组对此提出假设:
①提出这种假设的依据可认为是低温影响__________,使细胞不能正常进行有丝分裂。
②按照你的设计思路,实验结果检测应以__________作为鉴别低温是否诱导细胞内染色体加倍的依据。
③低温处理植物材料时,通常需要较长时间才能产生低温效应,假定低温处理为10小时,请你设计一个实验,探究5种低温条件下,染色体数目加倍情况。以表格形式列出来(2分)。
④现有亲缘关系较近但存在生殖隔离的两种二倍体植物A和B,请用你所学过的生物技术或原理,培育出具有该两种植物遗传特征并且可育的六倍体植物。写出大致的培育过程(给提供秋水仙素等可用的药品和用具,培育过程中所形成的植物种类可分别用C、D、E等代表来说明):
a__________________________________________________。
b__________________________________________________。
c__________________________________________________。
⑤秋水仙素作用的原理是:在细胞分裂时__________,导致染色体不分离,从而引起细胞内染色体数目加倍。
答案:(1)NaH14CO2 (或其他碳酸氢盐) 实验步骤:①把适量含有NaH14CO3的营养液置入锥形瓶中,并选取生长正常的菜豆幼苗放人锥形瓶中 (2分) ②将上述装置放在温暖,阳光充足的地方培养 (2分)③检测菜豆幼苗光合作用的产物的放射性 (2分)(不答光合作用的产物不得分)解释:在光合作用产物中发现有
实验组
1
2
3
4
5
6
温度℃
1
2
3
4
5
常温
视野中染色体加倍细胞的数目
注:表中只写染色体数目扣1分,不用常温对照扣1分。④a.用秋水仙素诱导植物A(或B)幼苗产生四倍体C (1分) b.再用B与四倍体C杂交产生三倍体D (1分) c.再将三倍体D幼苗用秋水仙素处理即可产生可育的六倍体 (1分) (以上三步其他答法只要步骤合理,可得分) ⑤抑制纺锤体的形成 (1分)
31.(20分)某中学两个生物研究性学习小组分别作了如下调查;
小组一:调查人群中双眼皮和单眼皮(控制基因B和b)的遗传情况,统计结果如下表:
组别
婚配方式
家庭个数
子
女
父
母
单眼皮
双眼皮
单眼皮
双眼皮
1
双眼皮
双眼皮
480
56
186
55
183
2
单眼皮
双眼皮
320
72
81
80
87
3
双眼皮
单眼皮
380
97
85
90
108
4
单眼皮
单眼皮
73
36
0
37
0
小组二:调查某家庭某种遗传病患病情况并绘成如下遗传系谱图
请根据上述信息回答下列问题: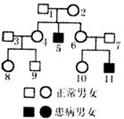
(1)据表格分析
①控制该性状的基因位于__________染色体上,第_______组的结果可判断该性状显隐性。
②第三组婚配双方的父母基因型分别是__________。
③第一组子女中该对基因为杂合的个体约占该组总数的__________%。
(2)根据遗传系谱分析:
①设该病为甲种遗传病,如果3号和7号均不带有致病基因,则该病的遗传方式是__________。按照该假设若9号与10号婚配,后代男孩患病几率为__________。
②设该病为乙种遗传病,如果3号不带有致病基因,而7号带有致病基因,则该病的遗传方式是__________。按照该假设若9号与10号婚配,后代患病几率为__________。
③假设5号和11号同时患有上述甲,乙二种遗传病,如果3号不带有致病基因,按照该假设,若9号与10号婚配后代只患一种遗传病的几率为__________。
④现想知道B号是否携带致病基因,可用__________进行基因诊断。
答案:(每空2分)(1)①常;1 ②Bb、bb ③51.25 (2)①X染色体的隐性遗传; ②常染色体的隐性遗传;
②常染色体的隐性遗传;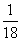 ③
③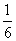 ④DNA分子探针
④DNA分子探针