2009年甲子中学高三化学考前预测试题
广东汕尾甲子中学 蔡坤联
第Ⅰ卷(选择题 共63分)
一、选择题 (本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1.下列叙述不正确的是( )
A.2008年北京奥运会的火炬燃料(丙烷),燃烧产物为二氧化碳和水,符合中国政府承诺的“绿色奥运”
B.
C.
D.2008年初,我国南方出现大面积的冰雪灾害,抗灾时通常使用的融雪剂中有:氯化钠、氯化镁、氯化钙等化合物
2.有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.自然界中存在大量单质硅
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.自然界硅的贮量丰富
3.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是
A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH-
B.表示H2燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(g);△H=-483.6kj/mol
 C.纯碱水解的离子方程式:CO32-
+ H2O
HCO3-
+
C.纯碱水解的离子方程式:CO32-
+ H2O
HCO3-
+
D.辛烷燃烧的热化学方程式:
△H= -11036kj/mol
4.几种短周期元素的原子半径及主要化合价如下表:
元素代号
L
M
X
R
T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
下列说法正确的是
A.离子半径大小:r(M3+)>r(T2-)
B.R的氧化物对应的水化物可能具有两性
C.X单质可在氧气燃烧生成XO3
D.L、X形成的简单离子核外电子数相等
5. 根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
①CaBr2+H20
③HgBr2+CaO
A.HBr B.
6.氢叠氮酸(HN3)与醋酸酸性相近,其盐稳定,但撞击发生爆炸产生氮气,有关氢叠氮酸的叙述:①NaN3的水溶液呈碱性;②HN3的固体属于分子晶体;③NaN3的固体属于离子晶体;④NaN3可用于小汽车防撞保护气囊。其中正确的是
A.①②③ B.②③④ C.①③④ D.全对
7.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( )
A.室温下,
B.
C.标准状况下,
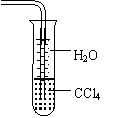 D.
D.
8.下列关于氨气的说法正确的是
A.氨可以用浓硫酸干燥也可用无水CaCl2干燥
B.氨水能导电,所以NH3是电解质
C.沸点:NH3<PH3<AsH3
D.用水吸收NH3用右图装置可防止倒吸:
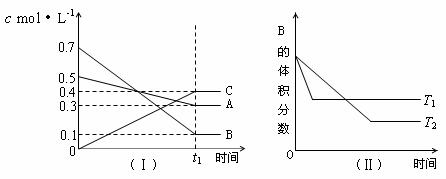
9.在恒容条件下化学反应: 2SO2 ( g ) + O2 ( g )ㄐ2SO3( g ) ; △ H =-QkJ?mol-1
在上述条件下分别充人的气体和反应放出的热量 ( Q )如下表所列:
容器
SO2 (mol)
O2(mol)
N2(mol)
Q(kJ?mol-1)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以上数据,下列叙述正确的是
A.在上述条件下反应生成 lmolSO3 固体放热 Q/2 kJ
B.2Q1 <2Q2=Q1<Q
C.Ql =2 Q2= 2Q3 = Q
D.2Q2 = 2Q3 < Q1 < Q
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
10.向某二价金属M的M(OH)2的溶液中加入过量的NaHCO3溶液,生成了MCO3
沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体。如要计算金属M的相对原子质量,你认为还必需提供下列哪项数据 ( )
A.M(OH)2溶液的物质的量浓度 B.与MCO3反应的盐酸的物质的量浓度 C.MCO3的质量 D.题给条件充足,不需要在补充数据
11.下列离子方程式中错误的是 ( )
A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O====SO +2HClO
+2HClO
B.FeBr2溶液中通入过量Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
|
 +Ba2++2OH-====BaSO4↓+2H2O
+Ba2++2OH-====BaSO4↓+2H2O +OH-=NH3↑+H2O
+OH-=NH3↑+H2O 13.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) ( )
13.如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化) ( )
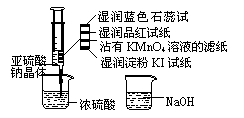 量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是 ( )
量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是 ( )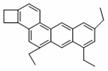 15.右图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为
15.右图是一种形状酷似一条小狗的有机物,化学家Tim Rickard将其取名为
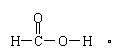
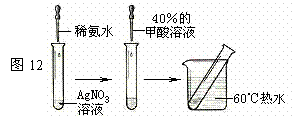 实验I:在甲酸溶液中滴加紫色石蕊试液;
实验I:在甲酸溶液中滴加紫色石蕊试液;
 实验方案请参考如下形式:
实验方案请参考如下形式:
 FeO(s)+CO(g) △H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) △H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)  ②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
②根据反应①与②推导出Q1、Q2、Q3的关系式Q3=_____________;
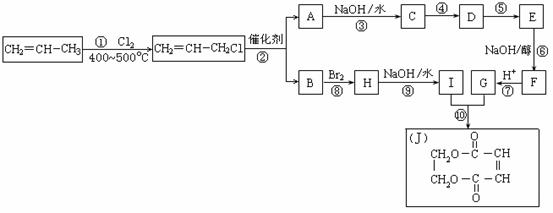
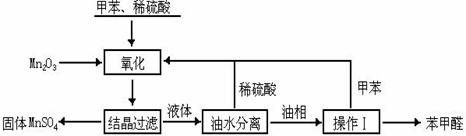

 ,其中E沸点最低的原因是 ,第三周期元素单质的熔点(℃)变化如下图I所示,其中h元素单质的晶体类型是
。
,其中E沸点最低的原因是 ,第三周期元素单质的熔点(℃)变化如下图I所示,其中h元素单质的晶体类型是
。 ②
②  或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)

