网址:http://m.1010jiajiao.com/timu_id_77325[举报]
1~5。CBBBC 6~9 DADD
10~
19.(8分,除注明的外,每空1分)
(1)丙 95(m2+m3)/
(2)甲 加热蒸发时,MgCl2水解,m2不是MgCl2的质量
(3)乙 偏高 原因是第③步有部分溶液被滤纸吸收,导致Mg(OH)2质量偏大
20.(10分)大试管、酒精灯、计时器(或秒表)(3分);(1)40.8 (2分)
(2)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应 (3分)
氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂或氧化铁的催化能力和二氧化锰的催化能力较好。其他合理也给分(2分)
21.⑴ 测定pH或滴加Na2CO3溶液或将甲酸滴加到滴有酚酞的NaOH溶液中(不应用金属Na)
⑵ 测定HCOONa溶液的pH或将等pH的HCOOH溶液和HCl溶液稀释相同倍数测其pH的变化或比较等浓度甲酸和盐酸的导电性等
⑶ 出现银镜
由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O
 ②
②
22. . (1)4mol/L(2分); 溶液的密度(1分)
(2)2NaClO3 + SO2 + H2SO4 = 2ClO2 + 2NaHSO4
 或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
(3)A(1分); (4)BED或ED(2分);重结晶(1分)
23 ..(1)吸热 (2) ①K3= K1/K2 吸热 DE
②Q3=Q1-Q2 (3)
24.(1)有部分KMO4被还原成MnO(OH)2 (1分)
(2)可在水浴中加热 (1分)
(3)A (1分)
(4)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (2分)
25.(8分)
(1)V2O5 + H2SO4 = (VO2)2SO4 + H2O(2分)
(2)2 1 2H+ → 2 2 2 H2O;(2分) a(1分)
(3) 0.8190 或 81.90% (3分,有效数字错误扣1分)
26.⑴ 取代反应 消去反应 加成反应
⑵
⑶ ④ 保护A分子中C=C不被氧化 
(4)
27.(1)使反应物充分接触,增大反应速率。(2)降低MnSO4的溶解度。
(3)稀硫酸 甲苯 (4)蒸馏 利用甲苯和苯甲醛的沸点差异使二者分离
(5)部分苯甲醛被氧化成苯甲酸。
28.(10分)
(1)1s22s22p63s23p1 (1分) (2) LiH (1分) CH4、NH3、HF、H2O(全对给2分) E分子间不能形成氢键(1分) 原子晶体(1分)
(3)15 (2分)
(4)KC8 (2分)
(12分)已知化学反应①Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。(3)能判断反应③已达平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O)D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式__________________。据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量 查看习题详情和答案>>
已知化学反应①:Fe(s)+CO2(g)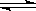 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)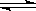 FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)
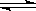 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .(3)在相同温度下,根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度
D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:①图甲中t2时刻发生改变的条件可能是________________.
②图乙中t2时刻发生改变的条件可能是 .
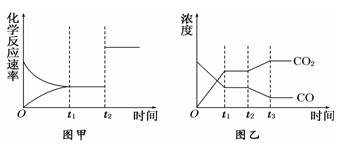
A.升高温度 B.降低温度 C.加入催化剂 D.增大压强
E.减小压强 F.充入CO2 G.分离出部分CO 查看习题详情和答案>>
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= 。(3)能判断反应③已达平衡状态的是 。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式 。据此关系式及上表数据,也能推断出反应③是 (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是 (填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量 查看习题详情和答案>>
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1173 K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
请填空:
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .(3)在相同温度下,根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号,下同).
A.增大压强 B.体积不变时充入稀有气体 C.升高温度
D.使用合适的催化剂 E.在体系中投入少量P2O5固体
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:①图甲中t2时刻发生改变的条件可能是________________.
②图乙中t2时刻发生改变的条件可能是 .

A.升高温度 B.降低温度 C.加入催化剂 D.增大压强
E.减小压强 F.充入CO2 G.分离出部分CO
(17分)已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2,在温度973 K和1 173 K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
 推断:反应①是 (填“吸热”或“放热”)反应。
推断:反应①是 (填“吸热”或“放热”)反应。(2)现有反应③:CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= ,根据反应①与②可推导出K1、K2与K3之间的关系式 ,据此关系式及上表数据,也能推断出反应③
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= ,根据反应①与②可推导出K1、K2与K3之间的关系式 ,据此关系式及上表数据,也能推断出反应③ 是 (填“吸热”或“放热”)反应。
是 (填“吸热”或“放热”)反应。(3)要使反应③在一定条件下建立的平衡向正反应方向移动同时υ正增大可采取的措施
有 (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
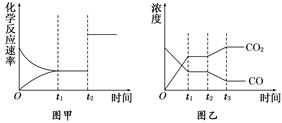
①图甲中t2时刻发生改变的条件是 。②图乙中t2时刻发生改变的条件是 。
(5)在830℃温度下,反应③的K值为1,在2 L的密闭容器中,加入1 mol CO2和3 mol H2充分反应达平衡时,CO平衡浓度为 mol/L。H2转化率 。若向容器中再加入1 mol CO2和3 mol H2 达到平衡后CO平衡浓度 mol/L ,CO2体积分数 查看习题详情和答案>>