鞍山市2008年初中毕业年级第一次质量调查
化 学 试 题(六?三制)
题号
一
二
三
四
五
总分
得分
※考试时间60分钟,满分80分。
可能用到的相对原子质量:H-
得分
评卷人
一、选择题(本大题包括12道小题,每小题只有一个选项符合题意。
1.生活中的许多变化都能产生热量,下列放热现象主要与化学变化无关的是 ( )
A.蜡烛燃烧时放出大量的热 B.生石灰与水混合放出大量的热
得分
评卷人
C.白炽灯泡通电后发热 D.苹果腐烂时发热
2.日常生活中的下列物质,属于纯净物的是 ( )
A.蒸馏水 B.天然气 C.含碘盐 D.食用醋
3.在①MgO、CuO、CaO、SO2;②C、Fe、S、P;③ZnCl2、BaCO3、HNO3、NaNO3三组物质中,每组各有一种物质在分类与组内其它物质不同,这三种物质分别是 ( )
A.CuO、Fe、S、ZnCl2 B.SO2、Fe、HNO3
C.CaO、C、BaCO3、HNO3 D.SO2、S、NaNO3
4.下列粒子的结构示意图中,表示同种元素的粒子是 ( )

A.①②③ B.③④ C.①② D.①④
5.白蚁分泌的蚁酸能蛀蚀木头,蚁酸的化学性质与盐酸相似,能腐蚀很多建筑材料。下列最不容易被白蚁蛀蚀的材料是 ( )
A.钢 B.铜 C.大理石 D.铝合金
6.在一定条件下,木炭、一氧化碳、氢气都能与氧化铜发生反应,下列叙述正确的是( )
A.反应后产生的气体都有毒 B.反应类型都是置换反应
C.反应后都能生成红色固体 D.反应前后各元素的化合价都发生了变化
7.不能说明分子间有间隔的是 ( )
A.食盐和蔗糖混合均匀 B.食盐溶解在水中
C.物质的热胀冷缩现象 D.等质量的氧气和液氧,氧气体积比液氧大
8.某有机物R在足量氧气中完全燃烧后的化学方程式如下:2R+13O2 8CO2+10H2O。根据质量守定律,R的化学式为 (
)
8CO2+10H2O。根据质量守定律,R的化学式为 (
)
A.C4H10
B.CH
9.下面对金属的利用不是由金属活动性决定的是 ( )
A.用铁回收含银废液中的银 B.用锌与稀硫酸反应制取氢气
C.古代金银制品能保存至今 D.用铝合金制作门窗框架
10.森林初发火灾时,可以使用爆炸灭火的方法,将灭火弹抛到火场爆炸将火扑灭。关于爆炸灭火原因的分析不合理的是 ( )
A.爆炸使燃烧处暂时缺氧 B.爆炸气浪降低了可燃物的温度
C.爆炸气浪降低了可燃物的着火点 D.炸起的沙土覆盖可燃物,隔绝空气
11.某溶液能与镁反应生成氢气,则下列各组物质在该溶液中能大量存在的是 ( )
A.KCl、NaOH、Na2SO4 B.NaCl、NaNO3、AgNO3
C.Na2CO3、NaCl、Na2SO4 D.HCl、NaCl、Na2SO4
12.治疗胃溃疡的胃药要求既可降低病人胃酸的含量又不能造成胃穿孔。下列物质中最适宜作为治疗胃溃疡的胃药成分的是 ( )
A.BaCO3 B.Al(OH)
二、填空题(本大题包括5道小题,共18分。)
13.(4分)用化学符号表示:
(1)2个氮原子____________; (2) 3个氢氧根离子_________;
(3)硫酸钙中钙元素显+2价_________;(4)4个二氧化硫分子 。
14.(4分)工业生产、人类生活与化学有着密切的关系,请你用C、H、O、Ca四种元素中的一种或几种(可重复使用)写出符合下列要求的物质的化学式:
(1)农村大力推广使用的沼气(又名天然气)的主要成分________;
(2)一种有毒气体,可用于铁的冶炼________;
(3)在农业上常用来改良酸性土壤的一种碱________;
(4)质量相同时,所含分子数最多的物质 。
15.(4分)右图为A、B两种固体物质的溶解度曲线。请回答下列问题:
 (1)曲线上Q点表示 ;
(1)曲线上Q点表示 ;
(2)在
A_______B(选填“>”、“=”或“<”);
(3)
16.(4分)向盛有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下。请分析并回答下列问题:
加入NaOH溶液的体积/mL
0
2
4
6
8
10
12
14
烧杯中溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
(1)当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应;
(2)当加入氢氧化钠溶液的体积为13mL时,溶液显 色;
(3)当烧杯中溶液的pH=1.4时,溶液中的溶质有哪些? 。
得分
评卷人
17.(2分)丙氨酸的化学式是C3H7NO2,请回答下列问题:
(1)丙氨酸的相对分子质量是 ,
(2)丙氨酸中氮元素的质量分数为 (计算结果精确到0.1%)
三、简答题(本大题包括5道小题,共20分。)
18.(2分)用实例来说明下列结论。
(1)化学变化中分子可分:_____________________________________________;
(2)分子的体积很小:_________________________________________________。
19.(2分)煤炉是农村冬季烧水、取暖的的必备用品,其燃料就是我们非常熟悉的蜂窝煤。在制作蜂窝煤的过程中,经常加入生石灰。在煤炉中,发生的化学反应有:
①SO2+ CaSO
CaSO 2CaSO4
2CaSO4
③2SO2+O2 2SO3 ④SO3+
2SO3 ④SO3+ CaSO
CaSO
根据以上条件回答:(1)以上反应属于 反应,(2)简要回答为什么在制作蜂窝煤的时要加入生石灰? 。
20.(5分)2006年一辆载有近30吨苯酚的槽罐车途经某市时发生侧翻,约有1 0吨的苯酚泄漏,空气中弥漫着浓烈的酸臭气味,对该市居民生活造成很大诚胁。苯酚是一种有毒的物质,对皮肤、黏膜有强烈的腐蚀作用。
(1)苯酚(化学式为C6H6O)属于_______________。(填“有机物”或“无机物”)
(2)现场救护人员应佩戴呼吸器,穿好防化服的原因是___________________________
(3)你认为下列对事故的处理方法合理的是_________。(填序号)
①用水进行冲洗或用泥土填埋
②挖隔离沟、铺薄膜防止扩散并回收泄漏的苯酚
③随时监测附近水源、土壤中的苯酚
(4)用木屑吸附残余的苯酚,然后燃烧处理。写出苯酚完全燃烧的化学方程式:___________________________________________
21.(5分)大棚种植蔬菜在冬季需保证充足的光照和补充气肥(CO2)。某同学在自家大棚内设计了补充二氧化碳的方法:将工业废酸(盐酸、硫酸、硝酸的混合酸)用水稀释后,盛放在塑料桶内,悬挂在高处。每天向桶内加适量的固体物质,如a、石灰石块,b、纯碱,c、碳酸氢钠,d、碳铵(NH4HCO3)等。试回答:
(1)农业技术员在选择向桶内所加物质时通常选碳铵,写出碳铵与废酸中二元酸反应的化学方程式,并说出选碳铵的两点理由。
(2)将塑料桶悬挂高处的原因是 。
 22.(6分)如下图所示中有A、B、C、D、E、F、G、H八种物质,它们分别是稀盐酸、碳酸钠、氢氧化钙、氢氧化钠四种溶液和木炭、锌、二氧化碳、氧化铜,凡用直线相连的两物质间均可以发生化学反应,且F中含有氢元素。(部分反应的条件已略去)
22.(6分)如下图所示中有A、B、C、D、E、F、G、H八种物质,它们分别是稀盐酸、碳酸钠、氢氧化钙、氢氧化钠四种溶液和木炭、锌、二氧化碳、氧化铜,凡用直线相连的两物质间均可以发生化学反应,且F中含有氢元素。(部分反应的条件已略去)
(1)试推断出下列物质:C__________、D_________、G_________、H_________。
(2)写出A和F反应的化学方程式________________________________________。
得分
评卷人
四、实验与探究题(本大题包括3道小题,共20分。)
23. (6分)小明设计了如右图所示装置测定空气中氧气的体积分数。
(6分)小明设计了如右图所示装置测定空气中氧气的体积分数。
(1)如果操作正确,整个实验中可观察到哪些现象?
(2)如果红磷燃烧时止水夹未夹紧橡皮管,请完成下表。
(请在考试结束后,到化学实验室验证你的猜想。)
可能出现的现象
实验结果会怎样?(“偏大”或“偏小”)
(3)小明认识到保证装置的气密性很重要,你会检验气密性吗?完成下面的不定项选择题:
下列实验现象能说明装置气密性良好的是_________(填代号)。

24.(7分)下图是实验室里常用的实验装置。
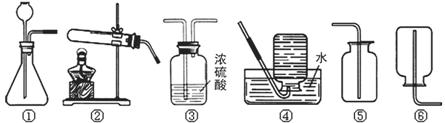
(1)加热氯酸钾和二氧化锰固体制取氧气,反应中二氧化锰起 作用,反应的化学方程式为 。为了制取和收集干燥的氧气应该选择的装置有(填序号) 。
(2)装置①可以进行多个化学实验,请写出一个用该装置进行的实验的名称: 。
(3)开动脑筋,大胆创新。将装置②进行改动,又可以设计出多种装置进行实验。
请你写出一个改动方案和相应实验的名称 、
。
25.(7分)某校学生在探究金属的化学性质,实验情况如下:
实验操作


实验现象
铝片表面产生大量的气泡
铝片表面产生很少的气泡
[提出问题]从上述实验中,你发现了什么问题?
;
[猜想]针对你发现的问题,分析其原因,大胆提出一个猜想:
。
[设计方案]根据你的猜想,任选下列实验用品,进行实验设计。
实验用品:10%的稀硫酸、30%的稀硫酸、相同大小的铝片(若干)、氯化钠、
试管、试管夹、酒精灯、镊子、药匙、砂纸
操作步骤
(用图示说明或文字叙述均可)
可能观察到的实验现象
相应的结论
[评价与反思]通过这次探究,你得到的启示或感受是:
得分
评卷人
五、计算题(本大题包括1道小题,共6分)
26.(6分)某脱氧保鲜剂主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁的性质来吸收包装袋内氧气,从而延长食品的保质期。已知一袋脱氧保鲜剂中活性铁粉的质量为
说明:1.本答案仅供评分时参考使用;
2.对于有多种答案的试题,这里只给一种或几种答案,其它答案若合理请参照此评分标准给分。
3.试题满分80分。
1
2
3
4
5
6
7
8
9
10
11
12
C
A
B
D
B
C
A
A
D
C
D
B
13.(1)2N (2)3OH― (3)CaSO4 (4)4SO2
14. (1) CH4 (2) CO (3) Ca(OH)2 (4) H2(每空1分,共4分)
15.(1)在
16.(1)10 (2)蓝 (3)NaCl和HCl(或氯化钠和盐酸)
17.(1) 89 (2)15.7%
18.化汞受热分解成氧气和汞;一滴水中含有15万亿亿个水分子。(各1分)
19.⑴化合反应 ⑵吸收煤燃烧时产生的SO2,以减少对大气的污染。(各1分)
20.(1)有机物 (2)苯酚有毒性和腐蚀性 (3)②③ (各1分)
(4)C6H6O+7O2 6CO2+3H2O(2分)
6CO2+3H2O(2分)
21.(1)2NH4HCO3+H2SO4= (NH4)2SO4+2H2O+CO2↑(2分)
理由:1、碳铵在农村是典型的化肥,材料易得。2、碳铵在与酸反应后会产生铵盐,碳铵作为氮肥的肥效不受影响。3、碳铵溶于水,与废酸反应充分;石灰石与废酸反应生成的CaSO4微溶,会覆盖在石灰石的表面,阻止反应的继续进行。(回答2点即可得2分)
(2)因为CO2密度比空气大,使CO2能与植物的叶片充分接触。(1分)
22.(6分)(1)C:CuO D:C G:NaOH H:Zn (各1分)
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(2分)
23.(1)红磷燃烧时产生大量“白烟”(1分);打开止水夹时,可观察到烧杯中的水倒流进集气瓶中,流入集气瓶的水约占原空气体积的1/5。(1分)
(2)
可能出现的现象
实验结果
一
烧杯中的导气管口有气泡冒出
偏大
二
烧杯中的水进入集气瓶中将红磷浇灭
偏小
上面两种情况学生回答出任何一种即可,如果“可能出现的现象”未答对,即便“实验结果”答对也不得分。
(影响集气瓶内压强的因素:①红磷燃烧时放热,使集气瓶内气体的温度升高,集气瓶内的气体受热膨胀;②红磷燃烧消耗集气瓶内的氧气导致集气瓶内压强降低。当因素①的作用大于因素②的作用时,集气瓶内压强增大。当因素①的作用小于因素②的作用时,集气瓶内压强减小)
(3)ABD(2分,只写一个或两个正确选项得1分,如果有错误选项就不得分)
24.(化学方程式每个2分,其余每空1分)(1)催化 2KClO3 2KCl+3O2↑
2KCl+3O2↑
②③⑤(少选、错选不得分)
(2)实验室制取氢气(或实验室制取二氧化碳;用双氧水制取氧气)
设计方案
实验名称
将酒精灯加网罩(或换酒精喷灯)
木炭还原氧化铜
或去掉酒精灯,将试管竖起
制取氢气或二氧化碳
取下塞子,导管伸到试管底部药品上方
氢气还原氧化铜
(3)
25.[提出问题]铝片放到稀硫酸中为什么没有现象? (1分)
[猜想]可能是铝片表面生成的致密氧化膜阻碍了反应的发生;
或可能与稀硫酸的浓度有关;
或可能是铝片与稀硫酸反应需要加热;
或Cl-可以加快铝与酸的反应。 (1分)
[设计方案]
方案一
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
将打磨后的铝片放入试管中,加入10%的稀硫酸
若有气泡产生
若没有气泡产生
猜想正确
猜想错误
方案二
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
取一支试管,放入一块铝片,加入30%的稀硫酸少许
若有气泡产生
若没有气泡产生
猜想正确
猜想错误
方案三
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
取一支试管,放入一块铝片,加入10%的稀硫酸少许,然后加热
若有气泡产生
若没有气泡产生
猜想正确
猜想错误
方案四
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
取一支试管,放入一块铝片,加入10%的稀硫酸少许,然后加入氯化钠
若有气泡产生
若仍然没有气泡产生
猜想正确
猜想错误
(只要猜想合理,且设计的方案与猜想一致均得分)
[评价与反思]: 善于发现问题,大胆质疑,勇于探究 (1分)
( 其他答案合理均得分)
26.解:设该脱氧保鲜剂最多能够吸收氧气的质量为x。
4Fe+6H2O+3O2=== 4Fe(OH)3 (1分)
224 96
 (1分)
(1分)
x=
能够吸收氧气的体积= (1分)
(1分)
包装盒内的空气所含氧气的体积为
答:一袋脱氧保鲜剂能将包装盒内的氧气吸收干净。