网址:http://m.1010jiajiao.com/timu_id_64469[举报]
说明:1.本答案仅供评分时参考使用;
2.对于有多种答案的试题,这里只给一种或几种答案,其它答案若合理请参照此评分标准给分。
3.试题满分80分。
1
2
3
4
5
6
7
8
9
10
11
12
C
A
B
D
B
C
A
A
D
C
D
B
13.(1)2N (2)3OH― (3)CaSO4 (4)4SO2
14. (1) CH4 (2) CO (3) Ca(OH)2 (4) H2(每空1分,共4分)
15.(1)在
16.(1)10 (2)蓝 (3)NaCl和HCl(或氯化钠和盐酸)
17.(1) 89 (2)15.7%
18.化汞受热分解成氧气和汞;一滴水中含有15万亿亿个水分子。(各1分)
19.⑴化合反应 ⑵吸收煤燃烧时产生的SO2,以减少对大气的污染。(各1分)
20.(1)有机物 (2)苯酚有毒性和腐蚀性 (3)②③ (各1分)
(4)C6H6O+7O2 6CO2+3H2O(2分)
6CO2+3H2O(2分)
21.(1)2NH4HCO3+H2SO4= (NH4)2SO4+2H2O+CO2↑(2分)
理由:1、碳铵在农村是典型的化肥,材料易得。2、碳铵在与酸反应后会产生铵盐,碳铵作为氮肥的肥效不受影响。3、碳铵溶于水,与废酸反应充分;石灰石与废酸反应生成的CaSO4微溶,会覆盖在石灰石的表面,阻止反应的继续进行。(回答2点即可得2分)
(2)因为CO2密度比空气大,使CO2能与植物的叶片充分接触。(1分)
22.(6分)(1)C:CuO D:C G:NaOH H:Zn (各1分)
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(2分)
23.(1)红磷燃烧时产生大量“白烟”(1分);打开止水夹时,可观察到烧杯中的水倒流进集气瓶中,流入集气瓶的水约占原空气体积的1/5。(1分)
(2)
可能出现的现象
实验结果
一
烧杯中的导气管口有气泡冒出
偏大
二
烧杯中的水进入集气瓶中将红磷浇灭
偏小
上面两种情况学生回答出任何一种即可,如果“可能出现的现象”未答对,即便“实验结果”答对也不得分。
(影响集气瓶内压强的因素:①红磷燃烧时放热,使集气瓶内气体的温度升高,集气瓶内的气体受热膨胀;②红磷燃烧消耗集气瓶内的氧气导致集气瓶内压强降低。当因素①的作用大于因素②的作用时,集气瓶内压强增大。当因素①的作用小于因素②的作用时,集气瓶内压强减小)
(3)ABD(2分,只写一个或两个正确选项得1分,如果有错误选项就不得分)
24.(化学方程式每个2分,其余每空1分)(1)催化 2KClO3 2KCl+3O2↑
2KCl+3O2↑
②③⑤(少选、错选不得分)
(2)实验室制取氢气(或实验室制取二氧化碳;用双氧水制取氧气)
设计方案
实验名称
将酒精灯加网罩(或换酒精喷灯)
木炭还原氧化铜
或去掉酒精灯,将试管竖起
制取氢气或二氧化碳
取下塞子,导管伸到试管底部药品上方
氢气还原氧化铜
(3)
25.[提出问题]铝片放到稀硫酸中为什么没有现象? (1分)
[猜想]可能是铝片表面生成的致密氧化膜阻碍了反应的发生;
或可能与稀硫酸的浓度有关;
或可能是铝片与稀硫酸反应需要加热;
或Cl-可以加快铝与酸的反应。 (1分)
[设计方案]
方案一
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
将打磨后的铝片放入试管中,加入10%的稀硫酸
若有气泡产生
若没有气泡产生
猜想正确
猜想错误
方案二
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
取一支试管,放入一块铝片,加入30%的稀硫酸少许
若有气泡产生
若没有气泡产生
猜想正确
猜想错误
方案三
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
取一支试管,放入一块铝片,加入10%的稀硫酸少许,然后加热
若有气泡产生
若没有气泡产生
猜想正确
猜想错误
方案四
操作步骤(用图示说明或文字叙述均可) (2分)
可能观察到的实验现象
(1分)
相应的结论
(1分)
取一支试管,放入一块铝片,加入10%的稀硫酸少许,然后加入氯化钠
若有气泡产生
若仍然没有气泡产生
猜想正确
猜想错误
(只要猜想合理,且设计的方案与猜想一致均得分)
[评价与反思]: 善于发现问题,大胆质疑,勇于探究 (1分)
( 其他答案合理均得分)
26.解:设该脱氧保鲜剂最多能够吸收氧气的质量为x。
4Fe+6H2O+3O2=== 4Fe(OH)3 (1分)
224 96
 (1分)
(1分)
x=
能够吸收氧气的体积= (1分)
(1分)
包装盒内的空气所含氧气的体积为
答:一袋脱氧保鲜剂能将包装盒内的氧气吸收干净。
在“空气中氧气含量的测定”实验探究中,小明设计了如右图所示实验装置,集气瓶下端为开口(即没有瓶底),上端瓶口有一带有燃烧匙的橡皮塞,瓶上带有刻度线,把集气瓶离水面的位置与橡皮塞之间的容积分成五等份。实验时把点燃的红磷立即插入集气瓶内,塞紧橡皮塞。回答下列问题:
(1) 如果不出现意外,火焰熄灭冷却后应观察到的主要的现象是 ;该实验化学反应的文字表达式是 ;
(2)关于空气中氧气含量的结论是 ,
(3)小红所测氧气含量结果与小明的有较明显的偏低,导致偏低的原因可能有(要求答出两种) 、 。
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
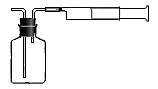
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100 mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J 查看习题详情和答案>>
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100 mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)
⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。
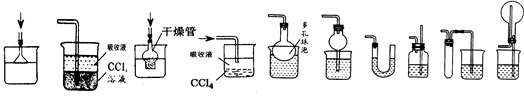
A B C D E F G H I J
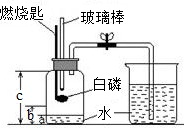
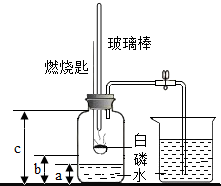 某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.
某化学研究性学习小组在学习了“空气中氧气含量测定”实验的基础上,改进了教材中的实验,设计出如图所示的实验装置.实验步骤如下:
①如右图所示连接仪器,检查装置的气密性良好.
②在集气瓶里装入适量a体积的水,燃烧匙里放一块白磷,在酒精灯上把玻璃棒下端加热后,立刻将集气瓶上的三孔胶塞塞紧.
③迅速将预热过的玻璃棒按下与白磷接触.观察到白磷燃烧,产生大量白烟.
④待白磷燃烧完毕,将集气瓶稍加振荡,白烟消失.
⑤待集气瓶完全冷却至室温,打开止水夹,量出集气瓶中水的体积为b,整个集气瓶的体积为c.
⑥根据a、b、c三个数据,计算出空气中氧气的体积分数.
根据以上实验信息,回答下列有关问题:
(1)为了充分消耗容器中的氧气,药品中白磷的用量应保证
(2)若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系
(3)小组成员小张对“实验前向集气瓶内装入适量a体积的水”不理解.咨询组长小明后,他终于明白加入水的作用,其一是
(4)小组成员小红无意间发现,向b体积水中滴加几滴石蕊溶液,溶液会变成红色.请你对“变红”现象的原因提出大胆地猜想