2009-2010学年重庆市西南师大附中第一学期初中九年级期中考试
化学试卷
(共四个大题,满分100分,考试时间:90分钟)
可能用到的相对原子质量:
H
一、选择题(本大题包括15个小题,每小题2分,共30分)每小题只有一个选项符合题意.
1. 日常生活中常见到下列现象,其中发生化学变化的是??????????????????????????????????????? ( )
A.冬天的早晨,玻璃窗上出现美丽的窗花
B.自行车轮胎在烈日下“爆炸”
C.牛奶放置时间过长结块
D.玻璃杯被打碎
2. 某阳离子的结构示意图为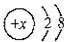 ,则x为?????????????????????????????????????????????????? ( )
,则x为?????????????????????????????????????????????????? ( )
A.9 B.
3. 发现元素周期表和元素周期律的科学家的是 ?????????????????????????????????????????????? ( )
A.拉瓦锡 B.道尔顿 C.门捷列夫 D.阿伏伽德罗
4. 空气中氧气和氮气的体积比约为?????????????????????????????????????????????????????????????????????? ( )
A.1┱1 B.1┱
5. 自然界中发生的下列现象不是由于空气污染造成的是??????????????????????????????????????? ( )
A.酸雨危害 B.海洋赤潮 C.光化学烟雾 D.臭氧层空洞
6. 我国的淡水资源非常匮乏,同学们在生活中要注意节约用水,保护水资源。下列是某附属中学初三(1)班的郑灿同学周日一天的用水情况,其中我们应该提倡的是????????????????????????????????????????????????? ( )
①早上间歇用水刷牙 ②中午淘米淘菜的水浇花
③吃饭后不间断用水洗碗 ④下午洗衣服的水用来冲厕所
⑤晚上洗澡打香皂时让水龙头继续流水
A.①②④ B.②③⑤ C.③④⑤ D.②④⑤
7. 下列有关实验现象的描述正确的是??????????????????????????????????????????????????????????????????? ( )
A.碳在氧气中燃烧,生成白烟
B.铁丝在空气中燃烧,发出耀眼的强光,生成黑色固体
C.硫在空气中燃烧,生成一种有刺激性气味的气体
D.红磷在空气中燃烧,生成五氧化二磷
8. 已知,若有m个水分子生成,则参加反应的氧原子的个数为??????????????????????????? ( )
A.m/2 B.m C.
9. 金属元素M只有一种化合价,其氧化物的化学式为MO,则下列化学式中错误的是( )
A.MCl2 B.MCO
10. 某纯净物在受热时发生分解反应生成水、二氧化碳和氨气(NH3)三种物质。下列对该物质的推断中,错误的是??????????????????????????????????????????????????????????????????????????????????????????????????????????????????????? ( )
A.该物质一定是化合物
B.该物质是由氢、氧、氮、碳四种元素组成的
C.该物质是由水分子、二氧化碳分子、氨分子构成的
D.该物质中氮、氢、碳、氧元素的质量比可能是14∶5∶12∶48
11. 下列化学方程式书写完全正确的是??????????????????????????????????????????????????????????????????? ( )
A.2H2O = 2H2 + O2 B.Mg + O2 MgO2
MgO2
C.4Fe + 3O2 2Fe2O3 D.CO2 + Ca(OH)2 = CaCO3↓+ H2O
2Fe2O3 D.CO2 + Ca(OH)2 = CaCO3↓+ H2O
12. 下列各反应中,各物质之间的质量比为1∶1∶2的是??????????????????????????????????????? ( )
A.H2 +Cl2 2HCl
B.N2
+O2
2HCl
B.N2
+O2 2NO
2NO
C.S + O2 SO2
D.Fe +
S
SO2
D.Fe +
S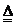 FeS
FeS
13. 英国《自然》杂志报道,科学家最近研制成了以锶原子做钟摆的“光格钟”,成了世界上最精确的钟。已知一种锶原子的相对原子质量为88,其质子数是38,则一个这种锶原子中含有的微粒总数为 ( )
A.38 B.
14. 下列转化必须通过化学变化才能实现的是???????????????????????????????????????????????????????? ( )
A.由混合物变为纯净物 B.由块状物变为粉末状
C.由固态物质变为气态物质 D.由化合物变为单质
15. 地壳中含量最多的金属元素、非金属元素和空气中含量最多的元素所组成的物质为 ( )
A.Fe(NO3)3 B.Al(NO3)
二、填空题(本大题包括6个小题,共46分)
16. (6分) 把符合题意的序号填在相应的位置上:
①干净的空气;②硫酸亚铁;③冰水混合物;④液氮;⑤氯化钠;⑥氙气;⑦高锰酸钾;⑧过氧化氢溶液;⑨黄金;⑩氧化铜
(1) 属于混合物的是__________________; (2) 属于化合物的是_________________;
(3) 属于单质的是____________________; (4) 属于氧化物的是_________________。
17.(6分) (1) 鱼油中富含的DHA(C22H32O2)是大脑细胞形成和发育不可缺少的物质。有关DHA,四位同学表述了如下的说法,请你将说法③和④补充完整,写在下面的横线上。
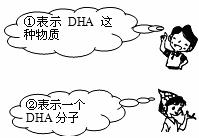
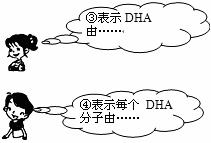
说法③:表示DHA由_______________________________________________________。
说法④:表示每个DHA分子由_______________________________________________。
(2)指出下列符号中“2”所表示的意义.
①2NO3―表示________________________;②O2表示____________________________;
③O-2表示___________________________;④Fe2+表示____________________________.
18.(8分) 写出符合条件的化学方程式:
(1)硫在空气中燃烧_______________________
(2)加热高锰酸钾制取氧气___________________
(3)锌跟稀硫酸反应制取氢气,同时还生成硫酸锌__________
(4)红磷在氧气中点燃____________________________
19.(4分) 高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂。高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在
(1) 高铁酸钾的物理性质是________________________。
(2) 高铁酸钾在保存时应注意避免______________________。
(3) 高铁酸钾与水反应的化学方程式如下,请在方框内填入化学计量数,在横线上填写化学式。
4K2FeO4 + 10H2O = 4Fe(OH)3↓+ 8KOH +□______________↑
20.(10分) 在一个密闭容器中盛有化合物X的水溶液和少量空气,向容器内加入化合物Y的粉末立即发生剧烈反应。测得反应前后有关物质的质量如下:
物 质
X
Y
H2O
O2(气)
反应前质量/g
1.7
0.5
32.3
0.1
反应后质量/g
0
0.5
33.2
0.9
(1)该密闭容器内发生的反应的类型是____________反应。
(2)化合物Y可能是_______________剂。
(3)组成化合物X的元素有______________。
(4)X的相对分子质量为34,则X的化学式是______________。
(5)容器中发生反应的化学方程式是______________________。
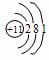
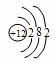
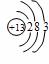
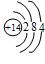
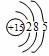
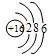
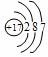

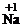
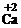
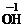
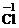
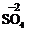
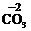
你由上表中得出的规律是:
离子的电量与化合价的_____________相等。离子的电性与化合价的___________相同。
①写出H+分别与Cl-、SO42-组成的化合物的化学式:___________,___________。
②写出OH-分别与Na+、Ca2+组成的化合物的化学式:___________,___________。
③写出Na+与CO32-,Ca2+与Cl-组成的化合物的化学式:___________,___________。
④已知①中的一种物质能与②中的一种物质发生反应,生成③中的一种物质和水,写出这个反应的化学方程式__________________________。
三、实验题(本大题包括2个小题,共12分)
22.(6分) 在“我们吸入的空气和呼出的气体有什么不同?”的探究活动中,某课外活动小组设计了如下图的装置来比较人体吸入的空气中二氧化碳的量与呼出的气体中二氧化碳的量。
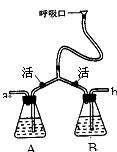
(1)在A瓶和B瓶中盛的无色溶液是__________________。
(2)在进行实验时,吸入的空气由_______(填“a”或“b”,下同)进入,呼出的气体由______排出。
(3)在实验结束时,能说明人体呼出的气体中二氧化碳比空气中的二氧化碳多的现象是_______________________________________________。
23.(6分) 在实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)的方法制取氧气。
(1)用过氧化氢分解制取氧气的装置如下图所示:
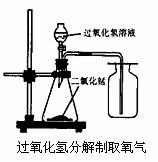
图中收集氧气的方法叫做___________________。
可用此方法收集氧气的原因是_________,收集氧气还可以用__________的方法。
(2)如果锥形瓶中的反应很剧烈,若要减慢反应速率应该采取的措施是( )
A.减慢液体滴加的速度 B.换用体积较小的锥形瓶 C.加热锥形瓶
(3)实验室用大理石和稀盐酸在常温下反应制取CO2气体,能否也能用此装置制取____________。(填“能”或“否”)
四、计算题(本大题包括2个小题,共12分)
24.(6分) 目前一些发达国家已基本采用新一代饮用水消毒剂ClO2,有的国家还颁布了强制使用ClO2的法律法规。请回答下列问题。(将计算结果填写在横线上)
(1)ClO2读作____________,它由__________、_________元素组成。
(2)ClO2中氯元素的化合价为__________。
(3)ClO2中氯元素和氧元素的质量比为_______,氯元素的质量分数为____。(准确至1%)
25.(6分) 实验室用过氧化钠(Na2O2)和水反应制取氧气,反应的化学方程式为:
2Na2O2 + 2H2O = 4NaOH + O2↑
如果用
(1)需要水的质量;
(2)生成氧气的质量;
(3)生成的氧气在标准状况下的体积(已知在标准状况下每
(计算结果准确至