2009年江苏名校高中单独招生考试(一)
化学试题
说明:本试题满分70分,考试时间35分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Fe:56 Zn:65 Ag:108
一、选择题(共12小题,每小题3分,共36分。每小题有1个或2个选项符合题意。错选、多选不得分,有两个正确答案而只选一个且正确的得1分)
1.甲醛(化学式为CH2O)是一种对人体有毒害的物质,是室内装饰材料释放的主要污染物之一,也是一些不法分子为了增强食品耐煮、防腐等能力,不顾人们的身体健康而经常使用的一种添加剂。国家为此对甲醛的使用进行了严格控制并严厉打击不法行为。下列关于甲醛的说法正确的是
A.甲醛是由碳、氢、氧三种元素组成的化合物
B.甲醛是由碳原子和水分子构成的化合物
C.由CO和H2制备甲醛的过程是物理变化
D.若甲醛的水溶液中氧元素的质量分数为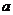 ,则碳元素的质量分数为
,则碳元素的质量分数为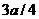
2.“保险粉”化学名为连二亚硫酸钠(Na2S2O4),主要用于印染工业。该化学品在受热时或在潮湿空气中极不稳定,易分解,化学方程式为: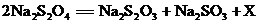 。下列有关说法错误的是
。下列有关说法错误的是
A.X的化学式为SO2
B.该反应属于分解反应
C.Na2S2O3中S的化合价为+3价
D.Na2S2O4通常要在干燥阴凉处密闭贮存
3.下列说法正确的是
A.含有氧元素的化合物一定是氧化物
B.含有碳元素的化合物一定是有机物
C.白色污染是指白色污染物造成的污染
D.纯净水清洁卫生,但长期饮用对健康无益
4.已知同温、同压下任何气体含有相同的分子数。工业制HNO3的尾气含NO2和NO,通常用NaOH溶液吸收,能够发生的所有反应方程式为: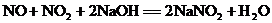 ,
,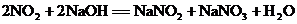 。NO2与NO的体积比为下列值时,用NaOH溶液不能完全吸收的是
。NO2与NO的体积比为下列值时,用NaOH溶液不能完全吸收的是
A.1┱1 B.2┱1 C.l┱2 D.4┱l
5.下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是
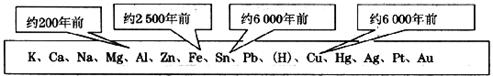
A.金属的活动性 B.金属的导电性
C.金属的延展性 D.地壳中金属元素的含量
6.现代城市中有各类喷泉,其原理利用了水的压强差。化学实验中的喷泉原理与其相似,应用了烧瓶内外的压强差。如下图所示,烧杯内盛有NaOH溶液,滴管中有NaOH溶液,实验时,先从滴管处挤入几滴NaOH溶液,随即打开止水夹,若要形成喷泉,烧瓶内的气体A可以是
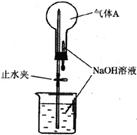
A.CO2 B.HCl C.H2 D.CO
7.在t℃时,某物质A的溶液若恒温蒸发
A.t℃时,原溶液是饱和溶液 B.t℃时,A物质的溶解度为
C.t℃时,A物质的溶解度为
8.将下列各组物质混合后溶于水,得到无色透明溶液的是
A.KNO3、ZnCl2、Na2SO4 B.FeCl3、NaOH、KNO3
C.CuSO4、NH
9.如下图,将气体X和气体Y同时通入液体Z,最终一定能看到液体变浑浊的是
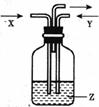
X
Y
Z
A
O2
CO
石灰水
B
HCl
CO2
石灰水
C
CO2
CO
氯化钙溶液
D
HCl
H2
硝酸银溶液
10.若用实验证明CuCl2溶液显蓝色不是由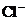 离子造成的,下列实验无意义的是
离子造成的,下列实验无意义的是
A.观察KCl溶液的颜色
B.向CuCl2溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液蓝色消失
C.向CuCl2溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液蓝色未消失
D.加水稀释CuCl2溶液后蓝色变浅
11.两烧杯中分别盛有等体积、等质量分数的H2SO4溶液。现向甲杯中加入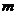 gMg,向乙杯中加入
gMg,向乙杯中加入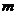 g Zn,充分反应后,有一烧杯中仍有金属未溶解,则下列说法正确的是
g Zn,充分反应后,有一烧杯中仍有金属未溶解,则下列说法正确的是
A. 一定是Mg剩余
B.一定是Zn剩余
C.生成氢气的质量一定相等
D.H2SO4的质量范围是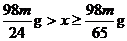
12.往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,待反应完成后再过滤,不可能存在的情况是
A.滤纸上有Ag,滤液中有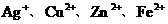
B.滤纸上有Ag、Cu,滤液中有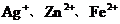
C.滤纸上有Ag、Cu、Fe,滤液中有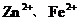
D.滤纸上有Ag、Cu、Fe、Zn,滤液中有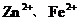
二、(共4小题,满分24分)
13.下表数据是在某温度下,金属镁和镍(Ni)分别在氧气中进行氧化反应时,在金属表面生成氧化物薄膜的实验记录:
反应时间/h
1
4
9
16
25
MgO层厚/nm
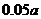
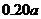
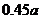
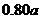

NiO层厚/nm
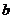
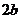
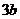
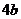
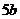
注: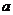 和
和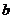 均为与温度有关的常数
均为与温度有关的常数
请回答:Mg与Ni比较,__________更易氧化,其理由是__________________________。
14.在有机物里有一大类物质叫醇,其中部分饱和一元醇的名称和化学式如下表,请完成表中空格。
名称
甲醇
乙醇
丙醇
丁醇
……含有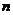 个碳原子的饱和一元醇
个碳原子的饱和一元醇
化学式
CH4O
C2H6O
C3H8O
C4H10O
15.由碳元素形成的单质和化合物的种类是所有元素中最多的,我们在初中阶段已经接触到的含碳物质就有好多种,如:①金刚石、②石墨、③CO、④CO2、⑤Na2CO3等,还有很多有机物。随着科学的发展,我们又有了很多新的发现:⑥C60、⑦C3O2、⑧C4O3、⑨C5O3、⑩C12O9等。请分析上述材料并回答下列问题:
(1)其中属于碳的单质的有________(填序号,下同),属于碳的氧化物的有_________;
(2)如果某碳的氧化物中含氧量为50%,则该碳的氧化物的化学式为__________,写出由C和CO2在高温下化合为该碳的氧化物的化学方程式____________________。
16.A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。请回答;
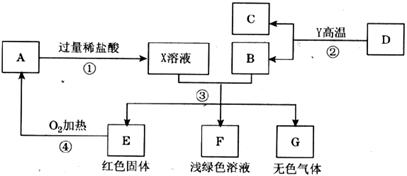
(1)A物质的化学式__________。
(2)C物质固态时的名称__________,该固体物质在实际生活中的一种用途是_______ ____________________________________________________________。
(3)写出反应③中生成红色固体的化学方程式______________________________。
(4)写出G与A反应的化学方程式________________________________________。
三、(共1题,满分10分)
17.某课外活动小组收集到一些废弃的硝酸银溶液,准备将其中的银元素以单质的形式全部回收。于是,他们进行了以下的实验活动:
【设计方案】①加入比银活泼的金属单质置换出银 ②除去金属混合物中的杂质
【小组讨论】
①选择加入的金属
甲同学认为:向硝酸银溶液中加入过量的铜粉,则得到的金属混合物含有银和铜;
乙同学认为:向硝酸银溶液中加入过量的铁粉,则得到的金属混合物含有银和铁。
你认为__________同学的方案更合理,其原因是______________________________。
②为除去银粉中混有的金属,可以向金属混合物中加入的试剂(硝酸银溶液除外)是____________________。
【实验过程】
①硝酸银溶液 金属混合物+溶液A
金属混合物+溶液A
②金属混合物 Ag+溶液B
Ag+溶液B
请回答:
操作a是__________,此操作中需要用到的玻璃仪器有:烧杯、玻璃棒和__________。
【产品检验】
请你设计一种简单方法检验得到的销酸银中是否还含有活泼金属,方法是___________ _________________________________________________。
【定量分析】他们取了