2008-2009学年度辽宁省锦州市第二学期九年级质量检测(一)
化学试卷
可能用到的相对原子质量:H
一、选择题(本大题包括12道小题,共16分。1小题~8小题每小题1分,9小题~12小题每小题2分。每小题只有一个选项符合题意,请将符合题意选项的标号填在相应的括号内)
1.物质的下列用途,是利用了其物理性质的是 ( )
A.用氮气作充气包装保鲜食品 B.用二氧化碳灭火
C.用活性炭除去冰箱异味 D.用稀盐酸除铁锈
2.生活中的下列做法科学合理的是 ( )
A.在发酵的面团中放入适量纯碱以除去酸味
B.用甲醛溶液浸泡海产品以延长保质期
C.在煤火炉附近放一盆水以防止煤气中毒
D.经常用水清洗自行车以防止锈蚀
3.材料与人类生活关系密切。下列有关材料的说法不正确的是 ( )
A.金属和合金都属于金属材料 B.纤维、橡胶、塑料都属于合成材料
C.用灼烧的方法可区分天然纤维和合成纤维 D.合成材料的使用有利也有害
4.对生活中的下列现象解释不正确的是 ( )
A.物体热胀冷缩――分子大小随温度的变化而改变
B.夏天海水蒸发得比其它季节快――分子运动速率随温度的变化而改变
C.把蔗糖放入水中,蔗糖固体很快消失――分子之间有间隔,分子在不断运动
D.加热氧化汞生成汞和氧气――化学变化中,分子可分,原子不可分
5.对下列四种粒子的结构示意图理解正确的是 ( )
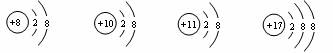
①它们都属于离子;②它们都具有相对稳定结构;③它们的核外电子排布相同;④它们属于不同种元素
A.①② B.②③ C.③④ D.②④
6.下列各组物质,按混合物、化合物、单质顺序排列的是 ( )
A.过氧化氢、水、氧气 B.沼气、天然气、甲烷
C.澄清的石灰水、硝酸钾、液态氮 D.液态空气、铁锈、水银
7.在家用燃气中加入有特殊臭味的乙硫醇可提示燃气是否泄漏。乙硫醇(用X表示)燃烧时发生的反应为:2X+9O2  4CO2+2SO2+6H2O,则X为
( )
4CO2+2SO2+6H2O,则X为
( )
A.C4H12S2 B.C2H6S C.C2H6O2S D.C2H6S2
8.依据氯元素的化合价的不同,有关物质按照一定的规律可排列为:①NaCl ②Cl2
③HClO ④R ⑤Cl2O7,则R可以是下列物质中的 ( )
A.KClO3
B.Ca(ClO)
9.某同学对所学部分化学知识归纳如下,其中都正确的一组是 ( )
A
物质性质与用途
B
日常生活经验
O2具有可燃性――用作燃料
CO具有还原性――冶炼金属
衣服上的油污――用汽油或酒精或肥皂液搓洗
暖水瓶内的水垢――用食醋清洗
C
化学与健康
D
安全常识
食用碘盐――预防甲状腺疾病
缺铁――易患骨质疏松症
用试管加热液体――试管口不能对着人
室内燃气着火――立即打开门窗通风
10.下图是甲、乙、丙三种物质的溶解度曲线,将甲、乙、丙三种物质t
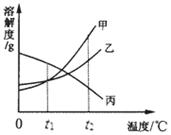
A.甲>乙>丙 B.甲=乙=丙 C.甲=乙>丙 D.丙>甲=乙
11.下列除去杂质的方法中,正确的是 ( )
物质
杂质
除杂质的方法
A
CO2
CO
点燃
B
CuO
Cu
加入过量的稀盐酸,过滤
C
NaCl溶液
Na2CO3
加入稀硫酸至不再产生气泡
D
KOH溶液
K2CO3溶液
加入适量的氢氧化钙溶液,过滤
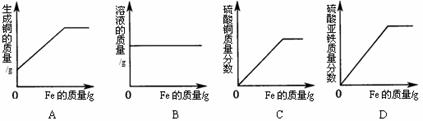
12.将足量的细铁丝放入一定量的硫酸铜溶液中,则下列图像表示正确的是 ( )
二、填空题(本大题包括6道小题,每空1分。共18分)
13.用化学符号表示:1个镁原子 ;3个五氧化二磷分子 ;2个氢氧根离子 ;氯化铁 。
14.学校食堂某日午餐的食谱如下:米饭、红烧鱼、炖豆腐汤,这份午餐中主要含有的营养素有:糖类、________、油脂、无机盐和水。从“合理膳食”的角度分析,还需要增加的食物是 。
15.人类的日常生活和工农业生产都离不开水。请回答下列与水有关的问题:
(1)房屋失火时,消防队员通常用水灭火,其原理是____________________ 。
(2)硬水会给生产和生活带来许多不便,生活中降低水的硬度,可采取________ _的
方法。
(3)农业和园林浇灌植物时,将大水漫灌改为喷灌、滴灌的目的是 。
16.能源和环境与人类的生存和发展关系密切。请你回答下列问题:
(1)当今社会,人们生活和生产所需的能量主要来自化石燃料的燃烧。化石燃料包括
_________、石油和天然气;
(2)化石燃料燃烧会产生大量的二氧化碳。大量的二氧化碳排放到空气中,导致的环境问题是 。为遏制这一环境问题,你自身能做到的一件事是
。
17.对于稀硫酸而言,溶质的质量分数越大,溶液的酸性越强。常温下,10%的稀硫酸的
pH________(填“大于”、“小于”或“等于”)2%的稀硫酸的pH。如果要使稀硫酸的pH升高,你采取的方法有:
(1)不发生化学反应的方法:_____________________________;
(2)利用化学反应的方法可有多种,请你任选两种方法(只要求写出所加物质的名称
或化学式,且要求所选两种方法所用的物质的类别不同):_______ ___、___ __ ____。
18.实验台上提供了铁丝、锌片、铜片、稀盐酸、硫酸铜溶液、硝酸银溶液6种药品。为探究金属的活动性顺序,小红同学利用上述药品进行了如下的实验:
实验一:将锌片与铜片分别放入稀盐酸中,锌片表面有气泡产生,铜片无明显变化;
实验二:将铁丝放入硫酸铜溶液中,铁丝表面有红色物质生成;
实验三:将铜片放入硝酸银溶液中,铜片表面有银白色物质生成。
(1)小红的上述实验可得出的金属活动性关系是______________________________;
(2)要确定铁、锌、铜、银四种金属的活动性顺序,小红还应补充的实验是
______ _ _(利用现有条件)。
三、简答题(本大题包括4道小题,共18分)
19.(5分)金属在人们的生活、生产中有着广泛的应用。
(1)地壳中含量最高的金属元素是 ;
(2)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
合 金
合金的主要性能
主要成分及纯金属的性能
焊 锡
熔点
锡:熔点
硬 铝
强度和硬度好
铝、铜、镁等。硬度小,质软
不锈钢
抗腐蚀性好
铁、铬、镍等。纯铁抗腐蚀性不如不锈钢
由上表推断,与组成合金的纯金属相比,合金的优点一般有(填序号) ;
①强度更低 ②硬度更高
③熔点更高 ④抗腐蚀性更好
(3)生活中的铁制品容易锈蚀。铁制品锈蚀的主要原因是 ;
(4)生活中的铝制品却不易锈蚀,原因是 ;
(5)提出下列保护金属资源的建议,其中合理的是 (填字母)。
①防止金属制品腐蚀 ②回收利用废旧金属制品
③提倡大力开采金属矿石资源以满足需要 ④开发使用金属代用品
20.(4分)写出下列反应的化学方程式:
(1)细铁丝在氧气中燃烧 ;
(2)用天然气作燃料 ;
(3)用氢氧化铝的药物治疗胃酸过多症 ;
(4)氯化铵(NH4Cl)与熟石灰混合研磨 。
21.(4分)物质之间既相互联系,又存在规律,这是我们学好化学应该掌握的一种基本方法。请你仿照下表中示例,找出O2、CH4、CO2、NH3、C2H4(乙烯)五种气体之间存在的另外两个规律,并排列出顺序,将答案填在下表的空格内。
规律
排列顺序
示例:标准状况下,密度由小到大
CH4、NH3、C2H4、O2、CO2
(1)
(2)
22.(5分)A、B、C、D、E、F、G、H、I都是初中化学学过的物质。其中E、F、H均为黑色固体,B为紫红色固体,D为混合物。他们之间有下图的转化关系(部分生成物已省去)

(1)用化学式表示D的组成: __________________、___________________。
(2)F→G的反应类型:_____________________。
(3)写出F→E的化学方程式:____________________________。
(4)指出B的一种用途: ___________________。
四、实验与探究题(本大题包括3道小题,共20分)
23.(6分)根据下列仪器,回答有关问题:
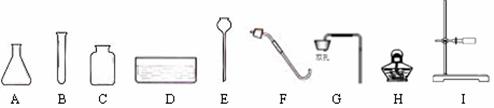
(1)上图A、B、C、D中能直接加热的仪器是 (填写仪器名称)。
(2)下图为小明组装的二氧化碳制取装置,装药品前首先进行的操作是 。
他认为该装置也可用于制取氧气,其制取氧气的化学方程式为_______ _。收集二氧化碳和氧气都可用的一种方法是 。

(3)小明拟选用仪器B、C、F、H再设计一套制取氧气的装置,他还需选用图中的仪器有________ _(填写仪器序号),该装置中所用的药品是______________(填写药品名称)。
24.(5分)在实验室,小刚想用紫色石蕊试液鉴别稀硫酸、氢氧化钠和碳酸钠三瓶无色溶液。请你帮助他完成实验。
(1)首先被鉴别出来的一种溶液是 ,依据的现象是
。
(2)利用现有条件将另外两种溶液鉴别出来,填写下面的实验报告。
实验步骤
实验现象及结论
25.(9分)暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
白色粉末的成分
形成的原因
可能是CaCO3
石灰水与空气中CO2反应
化学方程式为:
可能是
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解。于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是: 。
Cl-
CO32-
NO3-
Ca2+
微
溶
不
溶
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤
可能观察到的现象
结论
取上述试管中的上层清液,滴加1~2无色酚酞试液
往上述试管中的残留的固体中加入稀盐酸
白色粉末中 (选填“有”或“无”)CaCO3
由上述实验可知白色粉末的成分是: 。
五、计算题(本大题包括2道小题,共8分)
26.(2分)碳酸氢铵是农业生产上常用的一种氮肥。下图是某化肥厂生产的碳酸氢铵化肥包装袋上标签的部分文字。请你通过

计算填写下列空白:
(1)碳酸氢铵中氮、氢、碳、氧元素的质量比为 ;
(2)这种化肥实际含碳酸氢铵的质量分数为 (结果精确到0.1%)。
27.(6分)将
(1)石灰石中碳酸钙的质量分数;
(2)反应后所得溶液中溶质的质量分数。(结果精确到0.1%)