2008-2009学年度淄博市周村第一学期九年级期末考试
化学试卷
相对原子质量:H:
一、选择题(每小题有1―2个正确答案,请将各小题的正确选项填入后面的表格内)
1.一些食物的近似pH如下表:
食物
苹果
葡萄
牛奶
玉米粥
pH
2.9~3.3
3.5~4.5
6.3~6.6
7.2~8.0
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最适宜使用上述食物中的
A.苹果 B.葡萄 C.牛奶 D.玉米粥
2.汶川大地震后,全国各地为灾区运去了大量白菜、胡萝卜、油菜等蔬菜,这些物质可直接为人体补充的营养素是
A.脂肪 B.维生素 C.蛋白质 D.糖类
3.有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是

A.a物质的溶解度随着温度的升高而增大
B.在t
C.t
D.将a、b两种物质的饱和溶液从t
4.下列化学反应中属于复分解反应的是
A.2Fe2O3+ 4 Fe+3CO2↑ B.H2CO3=H2O+CO2↑
4 Fe+3CO2↑ B.H2CO3=H2O+CO2↑
C.3Fe+2O2  Fc3O4 D.K2CO3+CaCl2=CaCO3↓+2KCl
Fc3O4 D.K2CO3+CaCl2=CaCO3↓+2KCl
5.下列关于金属的说法中,正确的是
A.篮球架的表面喷涂油漆,主要是为了美观
B.回收金属饮料罐,只是为了减少环境污染
C.银的导电性比铜好,所以常用银作电线而不用铜
D.不锈钢抗腐蚀性好,常用于制医疗器械、炊具等
6.小军同学在做家庭小实验时,向热的大米粥中加入碘酒,发现未变蓝色。面对“异常现象,他不应该采取的做法是
A.向老师请教 B.认为自己做错了,继续做其它实验
C.查找相关资料,探究原因 D.反复实验,并观察是否有相同现象
7.下列方案合理的是
A.制备NaOH溶液将饱和的Na2CO3溶液与适量的石灰水混合后过滤
B.检验碳酸根离子:将要检验的物质与稀盐酸混合,观察是否产生气泡
C.鉴别H2、CH4、CO三种气体:分别将燃着的木条伸入集气瓶内,观察现象
D.验证质量守恒定律选用NH4Cl溶液与NaOH溶液,比较反应前后溶液的总质量
8.下面对芝麻酱说明书的判断正确的是
芝麻酱
每
蛋白质:
(含钙:相当于
A.不含微量元素 B.不含糖类和油脂
C.婴儿最好不食用 D.钙铁含量低于豆腐和鸡蛋
9.下列应用的原理用化学方程式表示正确的是
A.用适量的稀盐酸除铁锈:Fe2O3 + 6HCl =2FeCl2 + 3H2O
B.用一氧化碳作燃料:CO+O2 CO2
CO2
C.高温煅烧石灰石制取生石灰:CaCO3 CaO+CO2
↑
CaO+CO2
↑
D.用红磷燃烧测定空气中氧气含量:S + O2  SO2
SO2
10.中国科学技术大学的化学家在
A.金刚石是一种化合物 B.碳是金属元素
C.该反应中生成了新的原子 D.该反应是置换反应
11.将洁净的铁丝浸入含有Ag(NO3)2和Zn(NO3)2和电镀废水中,一段时间后取出,铁丝表面覆盖了一层物质,这层物质是
A.Ag、Zn B.Ag C.Zn D.Ag、Fe
12.以下是四位同学对生活中的现象进行探究后的结果的表述,其中不正确的是
A.“纯碱”其实不是碱,属于盐类
B.可用纯碱代替洗涤灵洗涤餐具表面的油污
C.用纯碱可除去面团发酵产生的酸
D.用加水溶解的方法检验纯碱中是否混入了食盐
13.汽车、电动车一般使用的是铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸,现用
A.28%的稀硫酸中溶质与溶剂的质量比为28∶100
B.用l
C.配制该稀硫酸时,把水沿容器内壁缓慢注入浓硫酸中
D.配制好的稀硫酸可以存放在铁制容器中
14.下列图像能正确反映所对应叙述关系的是
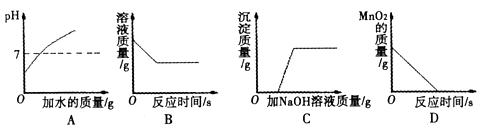
A.向pH=3的溶液中不断加水
B.一定量的稀硫酸与锌粒反应
C.向H2SO4和CuSO4混合液中加NaOH溶液
D.给氯酸钾和二氧化锰的混合物加热
15.
实验序号
水的质量(g)
加入NaCl的质量(g)
溶液的质量(g)
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
13.6
A.②中所得溶液是饱和溶液 B.
C.③④溶液的溶质质量分数相等 D.①所得溶液的溶质质量分数为20%
16.某研究小组测定Cu -Fe合金和Fe -Al合金中铁的质量分数。向
A.当粉末为Fe -Al合金时,a可能为
B.当粉末为Cu -Fe合金时,反应完全后,生成物的溶液里一定含有Fe2+和Cu2+
C.当粉末为Cu -Fe合金时,若a为
D.当粉末为Fe -Al合金时,所需稀硫酸溶质质量分数一定大于9.8%
17.下列各物质中的少量杂质,所选用的试剂及操作方法均正确的是
项目
物质
杂质(少量)
试剂
操作方法
A
KNO3
MnO2
足量的水
溶解、过滤、蒸发
B
H2
水蒸气
适量的NaOH溶液
洗气
C
硝酸
盐酸
过量的硝酸银溶液
过滤
D
CO
CO2
足量氧化铁
加热
18.图表资料可以为我们提供很多信息。下列从图表中获取的信息或相关应用不正确的是
A.从元素周期表中查找元素的原子能序数、元素符号、相对原子质量
B.根据金属元素在地壳的含量图,判断人类开发和使用金属的年代
C.根据金属活动性顺序表,判断金属材料是否容易被盐酸腐蚀
D.根据溶解度曲线图,选择从溶液中获得晶体的方法
19.物质王国的“小朋友”在做游戏,五位“小朋友”手拉手围成一圈(如下图所示),要求相邻的“小朋友”之间必须能互相“配合”(即必须能发生化学反应),他们才能将游戏进行下去。场外还有四位替补“队员”。下列有关说法正确的是
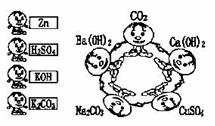
A.圈内相邻的“小朋友”之间均未能发生置换反应
B.五位“小朋友”中的任意两位均不能互相调换位置
C.若“Na2CO
D.若“Ba(OH)
20.有失去标签的甲、乙、丙、丁四瓶无色溶液,它们分别是稀盐酸、BaCl2溶液、K2CO3溶液、AgNO3溶液中的某一种。按照表中所述进行的实验和结论推出“丙+丁”的实验现象是(已知Ag2CO3难溶于水)
溶液间进行的反应
甲+丙
甲+乙
乙+丁
丙+丁
实验现象
有气体产生
有沉淀产生
有沉淀产生
A.一定有气体 B.一定有沉淀
C.可能有反应但无现象 D.可能没有反应
二、理解与应用
21.在日常生活中应注意合理摄取营养物质和人体必需的元素。
(1)蔬菜中所含的营养素主要是_____________________。
(2)蛋白质是构成生命的基础物质。是日常膳食的重要组成部分。下列食物中富含蛋白质的是______________________(填序号)。
①葡萄干 ②苹果 ③大豆 ④牛奶 ⑤米饭
(3)糖类是人体所需_____________________的主要来源。
(4)目前市场上有一种叫碘酸钙的保健品,其含有人体必需的微量元素是_______________。
22.为防止水体污染并回收某种金属,某工厂向含有硫酸铜的废水中加入一定量的铁粉,充分反应后过滤、洗涤、干燥得滤渣,取少量滤渣向其中加入稀盐酸产生气泡,则滤渣中一定含有的物质是 (填化学式),用化学方程式表示产生气泡的原因:__________________
23.今年5月1日起,北京市中小学校、体育馆等10类公共场所将全面禁止吸烟。这是实现无烟奥运、创建健康城市的重要举措。因为燃着的香烟产生的烟气中含有一种与血液中血红蛋白结合的有害气体,它是: 。
24.A、B、C、D都是九年级化学中的物质,它们存在下图所示的关系(反应条件略去)。
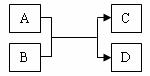
(1)若A为一氧化碳,C为金属,则D为__________;
(2)若A为常见金属,C为气体单质,则B为__________;
(3)若A为蓝色溶液,C为浅绿色溶液,则B为__________;
(4)若A为蓝色溶液,C为Cu(OH)2,则B为__________。
25.(4分)下图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。

(1)当温度为
(2)当温度 时,氯化钠的溶解度大于碳酸钠的溶解度;
(3)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。请你解释原因:“夏天晒盐”
;“冬天捞碱” 。
26.化学与生产生活、社会热点紧密联系。试回答:
(1)为防止钢坯在高温烘烤和轧制过程中表面被氧化,造成铁损耗,可在钢坯表面涂上一层纳米硅酸盐涂料。这种涂料应具有的化学性质是 。
(2)塑料是由石油炼制的产品制成的。自今年6月1日起,在全国范围内,实行塑料购物袋的有偿使用制度。从化学角度看,实行这一制度的好处是:
① ;② 。
27.请根据下表信息回答:
序号
金属
熔点/℃
导电性
硬度
化学性质
金属冶炼的大致年限
①
Al
660
61
2~2.9
常温下与氧气反应,表面形成致密的薄膜
约200年前
②
Fe
1535
17
4~5
在潮湿的空气着火易生锈
约3000年前
③
Cu
1083
99
2.5~3
在高温时易与氧气反应
约6000年前
说明:导电性以银的导电性为100作标准,硬度以金刚石的硬度为10作标准。
(1)菜刀用铁做而不用铝做的主要原因是 ;
(2)表中导电性最强的金属是 ;
(3)①中形成薄膜的化学方程式 ;
(4)金属的冶炼体现了人类文明的发展水平。之所以有先后,主要取决于 。
28.实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:

请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;固体B的化学式为 。
(2)写出步骤①其中一个反应的化学方程式 ;
步骤④发生反应的化学方程式为 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和 。
三、实验与探究
29.某合作小组欲探究Al、Cu、Ag三种金属活动性,特设计如下实验:把一根洁净的铝丝浸入硫酸铜溶液中,过一会取出,观察铝丝表面的现象把一根洁净的铜丝浸入硝酸银溶液中,过一会取出,观察铜丝表面的现象
(1)请填写下列空白
实验
现象
反应的化学方程式
铝丝浸入硫酸铜溶液中
2Al+3CuSO4=Al2(SO4)3+3Cu
铜丝浸入硝酸银溶液中
铜丝表面有银白色物质析出
(2)据此得出三种金属活动性由强到弱的顺序为____________________。
(3)该组同学发现,洁净的铝丝浸入硫酸铜溶液时,还观察到铝丝表面有气泡产生。你推断硫酸铜溶液pH__________7。(填>、<、=)
30.暑假,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末。为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
白色粉末的成分
形成的原因
可能是CaCO3
石灰水与空气中CO2反应的化学方程式为:
可能是
暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出
经过反复思考,同学们认为白色粉末还可能是 的混合物。
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解。于是他得出粉末中一定有CaCO3的结论。乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是: 。
Cl-
CO32-
NO3-
Ca2+
微
溶
不
溶
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
实验步骤
可能观察到的现象
结论
取上述试管中的上层清液,滴加1~2无色酚酞试液
往上述试管中的残留的固体中加入稀盐酸
白色粉末中 (选填“有”或“无”)CaCO3
由上述实验可知白色粉末的成分是: 。
(3)交流与反思:
①通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是 (选填序号)。
A.密封保存 B.使用前,临时配制 C.禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可用稀盐酸,请写出其中可能发生的反应的化学方程式(写出一个即可): 。
四、分析与计算
31.
(1)葡萄糖中碳、氢、氧三种元素的最简质量比为________,相对分子质量为_________。
(2)如果该学生一天(24h)所需的热量以摄入葡萄糖计算,理论上需葡萄糖多少克?
32.长久使用的热水瓶底部有一层水垢,主要成分是CaCO3
和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3
的含量。取
时间/min
1
2
3
4
5
质量/g
30
50
60
66
66
试回答下列问题:
(1)4分钟后,产生的CO2 不再增加,说明水垢中CaCO3 (填已或未反应完全?)
(2)该水垢中CaCO3 的质量分数是多少?